Différence entre l'acétaldéhyde et l'acétone
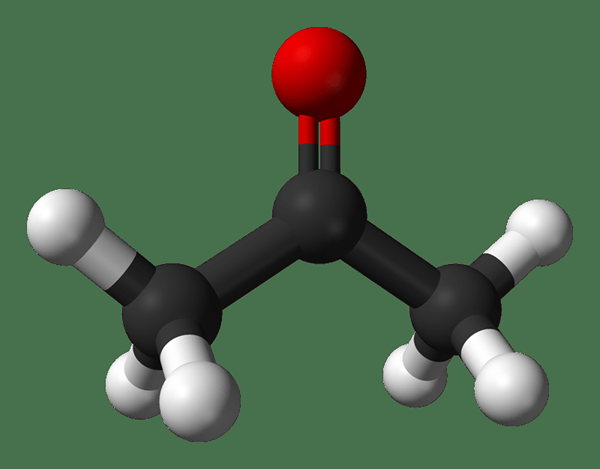
Différence clé - Acétaldéhyde vs acétone
L'acétaldéhyde et l'acétone sont de petites molécules organiques, mais il y a une différence entre eux en fonction de leurs groupes fonctionnels. En d'autres termes, ce sont deux composés carbonyle différents avec des propriétés chimiques et physiques différentes. L'acétone est le plus petit membre du groupe de cétone, tandis que l'acétaldéhyde est le plus petit membre du groupe aldéhyde. Le différence clé entre l'acétaldéhyde et l'acétone est le nombre d'atomes de carbone dans la structure; acétone a trois Atomes de carbone, mais acétaldéhyde a seulement deux atomes de carbone. La différence dans le nombre d'atomes de carbone et le fait d'avoir deux groupes fonctionnels différents conduisent à de nombreuses autres différences dans leurs propriétés.
Qu'est-ce que l'acétone?
L'acétone est le plus petit membre du groupe Ketone, également connu sous le nom propanone. C'est un liquide incolore, volatil et inflammable qui est utilisé comme solvant. La plupart des solvants organiques ne se dissolvent pas dans l'eau, mais l'acétone est miscible avec l'eau. Il est très souvent utilisé à des fins de nettoyage en laboratoire et en tant qu'ingrédient actif principal dans les liquides de démontage de vernis à ongles et dans le diluant de peinture. 
Qu'est-ce que l'acétaldéhyde?
Acétaldéhyde, également appelé éthanal est le plus petit membre du groupe aldéhyde. C'est un liquide incolore et inflammable avec une forte odeur étouffante. Il existe de nombreuses usages industriels tels que la production d'acide acétique, de parfums, de médicaments et de certaines saveurs.
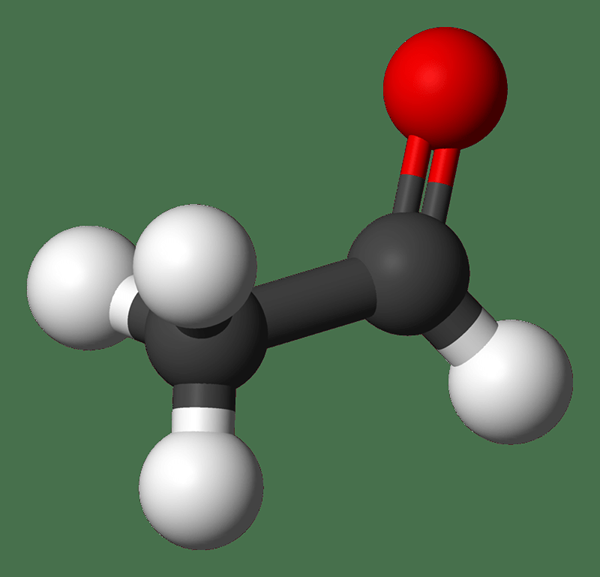
Quelle est la différence entre l'acétaldéhyde et l'acétone?
Structure et propriétés générales de l'acétaldéhyde et de l'acétone
Acétone: La formule moléculaire de l'acétone c3H6O. C'est le membre le plus simple de la famille Ketone. C'est un liquide volatil et inflammable avec une odeur piquante.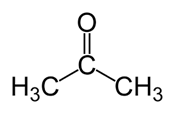
Acétaldéhyde: La formule moléculaire de l'acétaldéhyde c2H4O. C'est le plus simple et l'un des membres les plus importants de la famille aldéhyde. C'est un liquide incolore, volatil et inflammable à température ambiante.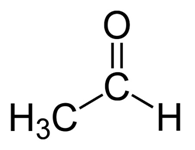
Occurrence d'acétaldéhyde et d'acétone
Acétone: En général, l'acétone est présente dans le sang humain et l'urine. Il est également généré et éliminé dans le corps humain pendant le métabolisme normal. Lorsque les gens ont des diabétiques, il est produit en plus grandes quantités dans le corps humain.
Acétaldéhyde: L'acétaldéhyde se trouve naturellement dans diverses plantes (café), pain, légumes et fruits mûrs. De plus, il se trouve dans la fumée de cigarette, l'essence et l'échappement diesel. De plus, c'est un intermédiaire du métabolisme de l'alcool.
Utilisations d'acétaldéhyde et d'acétone
Acétone: L'acétone est principalement utilisée comme solvant organique dans les laboratoires chimiques et est également l'agent actif dans la production de dissolvant de vernis à ongles et plus mince dans l'industrie de la peinture.
Acétaldéhyde: L'acétone est utilisée pour fabriquer de l'acide acétique, des parfums, des colorants, des agents aromatisés et des médicaments.
Caractéristiques de l'acétaldéhyde et de l'acétone
Identification
Acétone: L'acétone donne un résultat positif pour le test d'iodoforme. Par conséquent, il peut être facilement différencié de l'acétaldéhyde à l'aide d'un test d'iodoforme.
Acétaldéhyde: L'acétaldéhyde donne un miroir d'argent au "Réactif de Tollen" tandis que les cétones ne donnent pas de résultat positif pour ce test. Parce qu'il ne peut pas s'oxyder facilement. Le test d'acide chromique et le réactif de Fehling peuvent également être utilisés pour identifier l'acétaldéhyde.
Réactivité
La réactivité des groupes carbonyle (aldéhydes et cétones) est principalement due au groupe carbonyle (c = o).
Acétone: Généralement, les groupes alkyles sont des groupes de don d'électrons. L'acétone a deux groupes méthyle et diminuer la polarisation du groupe carbonyle. Par conséquent, cela rend le composé moins réactif. Deux groupes méthyle attachés aux deux côtés du groupe carbonyle conduisent également à plus de stéarique. Par conséquent, l'acétone est moins réactive que l'acétaldéhyde.
Acétaldéhyde: En revanche, l'acétaldéhyde n'a qu'un seul groupe méthyle et un atome d'hydrogène attaché au groupe carbonyle. Au fur et à mesure que le groupe méthyle donne des électrons, l'atome d'hydrogène retire les électrons; Cela rend la molécule plus polarisée, et cela rend la molécule plus réactive. Par rapport à l'acétone, l'acétaldéhyde a moins d'effets stéaétiques et d'autres molécules peuvent s'approcher facilement. Pour ces raisons, l'acétaldéhyde est plus réactif que l'acétone.


