Quelle est la différence entre l'acétate de sodium et le trihydraté de l'acétate de sodium
Le Différence clé entre l'acétate de sodium et le trihydrate d'acétate de sodium est que l'acétate de sodium est un composé chimique ayant la formule chimique nACh3COO, tandis que le trihydrate de l'acétate de sodium est la forme hydratée la plus courante d'acétate de sodium, composé de trois molécules d'eau associées à une molécule d'acétate de sodium.
L'acétate de sodium est le sel de sodium de l'acide acétique. L'acétate de sodium trihydraté est la forme hydratée la plus courante d'acétate de sodium.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'acétate de sodium
3. Qu'est-ce que l'acétate de sodium trihydraté
4. Acétate de sodium vs acétate de sodium trihydraté sous forme tabulaire
5. Résumé - acétate de sodium vs acétate de sodium trihydraté
Qu'est-ce que l'acétate de sodium?
L'acétate de sodium est le composé chimique ayant la formule chimique nach3COO. Nous pouvons l'abréger en tant que naoac. C'est le sel de sodium de l'acide acétique. L'acétate de sodium est un sel deliquescent incolore ayant une large gamme d'applications.
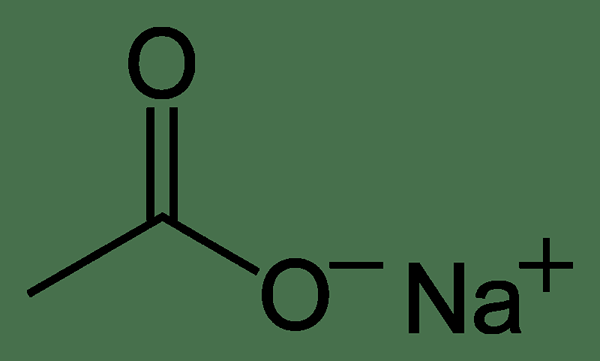
Figure 01: La structure chimique de l'acétate de sodium
The major applications of sodium acetate include using it as a carbon source for culturing bacteria in biotechnological applications, use in the textile industry to neutralize sulfuric acid waste streams, application in concrete longevity to migrate water damage to concrete by acting as a concrete sealant, in L'industrie alimentaire en tant qu'agent d'assaisonnement, pour fabriquer la solution tampon d'acétate de sodium et d'acide acétique, utilise dans des coussinets de chauffage, des réchauffeurs et de la glace chaude, etc.
L'acétate de sodium est un composé bon marché qui est généralement acheté au lieu de la préparation de laboratoire. Nous pouvons produire de l'acétate de sodium dans des expériences de laboratoire en utilisant la réaction de l'acide acétique (5-8%) avec du carbonate de sodium, du bicarbonate de sodium et de l'hydroxyde de sodium. Ces réactions peuvent produire de l'acétate de sodium et de l'eau.
Lorsque l'on considère la structure chimique de l'acétate de sodium, il a une structure cristalline sous une forme anhydre. Nous pouvons le décrire comme une alternance de carboxylate de sodium et de couches de groupe méthyle. Ce composé peut subir une décarboxylation, formant du méthane dans des conditions de forçage.
Quel acétate de sodium trihydraté?
L'acétate de sodium trihydraté est la forme hydratée la plus courante d'acétate de sodium. Il a trois molécules d'eau associées à une molécule d'acétate de sodium.

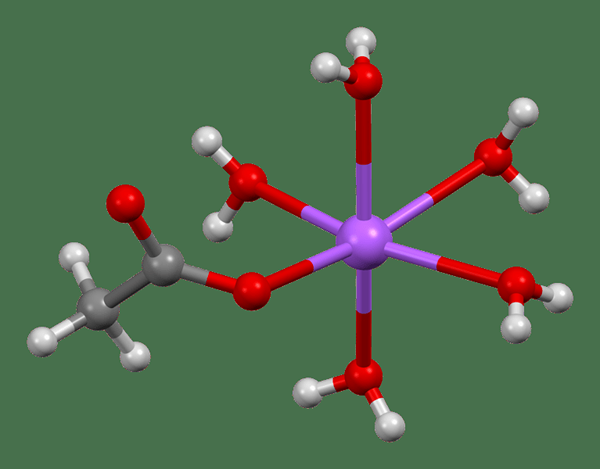
Figure 02: La structure chimique de l'acétate de sodium trihydrate
La structure de ce composés contient une coordination octaédrique déformée à l'ion sodium. Il apparaît comme une structure de chaîne unidimensionnelle.
Quelle est la différence entre l'acétate de sodium et le trihydraté de l'acétate de sodium?
L'acétate de sodium est le sel de sodium de l'acide acétique. L'acétate de sodium trihydraté est la forme hydratée la plus courante d'acétate de sodium. La principale différence entre l'acétate de sodium et le trihydrate d'acétate de sodium est que l'acétate de sodium est le composé chimique ayant la formule chimique nACh3COO, tandis que l'acétate de sodium trihydrate est la forme hydratée la plus courante d'acétate de sodium composée de trois molécules d'eau associées à une molécule de moléculé de sodium.
Il existe de nombreuses utilisations d'acétate de sodium, y compris l'utilisation comme source de carbone pour cultiver des bactéries dans des applications biotechnologiques, l'utilisation dans l'industrie textile pour neutraliser les flux de déchets d'acide sulfurique, l'application en longévité en béton pour migrer les dommages à l'eau en béton en agissant comme un scellant en condente, Utiliser dans l'industrie alimentaire comme agent d'assaisonnement, etc. Les utilisations du trihydrate d'acétate de sodium incluent comme source d'ions sodium dans des solutions, pour la dialyse, comme alcaliseur systémique et urinaire, diurétique et comme expectorant.
L'infographie ci-dessous répertorie les différences entre l'acétate de sodium et le trihydrate d'acétate de sodium sous forme tabulaire pour une comparaison côte à côte.
Résumé - acétate de sodium vs acétate de sodium trihydraté
L'acétate de sodium et l'acétate de sodium trihydrate sont des sels de sodium d'acide acétique. La principale différence entre l'acétate de sodium et le trihydrate d'acétate de sodium est que l'acétate de sodium est le composé chimique ayant la formule chimique nACh3COO, tandis que l'acétate de sodium trihydrate est la forme hydratée la plus courante d'acétate de sodium composé de trois molécules d'eau associées à une molécule de molécule de sodium.
Référence:
1. «Trihydrate d'acétate de sodium." Centre national d'information sur la biotechnologie. Base de données de composés PubChem, U.S. Bibliothèque nationale de médecine.
Image gracieuseté:
1. «Sodium-acétate-2D-squelettique» (domaine public) via Commons Wikimedia
2. «Sodium-acétate-trihydrate-xtal-na-coordination-3d-bs-17» par Ben Mills - propre travail (domaine public) via Commons Wikimedia


