Quelle est la différence entre la chaleur de solution et la chaleur de réaction
Le différence clé entre la chaleur de la solution et la chaleur de réaction Est-ce que la chaleur de solution est la quantité d'énergie thermique libérée ou absorbée par un système chimique lors de la formation d'une solution, tandis que la chaleur de réaction est la différence entre le réactif total et les enthalpies molaires totales du produit qui sont calculées pour les substances chimiques à l'état standard.
La chaleur de la solution et la chaleur de réaction sont des valeurs d'enthalpie importantes en chimie physique qui sont utiles dans la détermination des propriétés des solutions et des réactions chimiques.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la chaleur de solution
3. Qu'est-ce que la chaleur de réaction
4. Chaleur de solution vs chaleur de réaction sous forme tabulaire
5. Résumé - chaleur de solution vs chaleur de réaction
Qu'est-ce que la chaleur de solution?
La chaleur de solution ou l'enthalpie de la solution est la quantité d'énergie thermique libérée ou absorbée par un système chimique lors de la formation d'une solution. Cette valeur d'enthalpie est liée à la dissolution d'une substance dans un solvant qui est en pression constante, ce qui entraîne une dilution infinie.
Le plus souvent, la chaleur de la solution est donnée pour une température constante dans KJ / MOL. Il y a trois parties de ce changement d'énergie: la décomposition endothermique des liaisons chimiques qui existent dans le solvant, la décomposition des liaisons chimiques dans le soluté et la formation de forces d'attraction entre le soluté et le solvant. De plus, nous pouvons dire qu'une solution idéale contient généralement une enthalpie nulle de mélange tandis qu'une solution non idéale a une quantité molaire excessive.
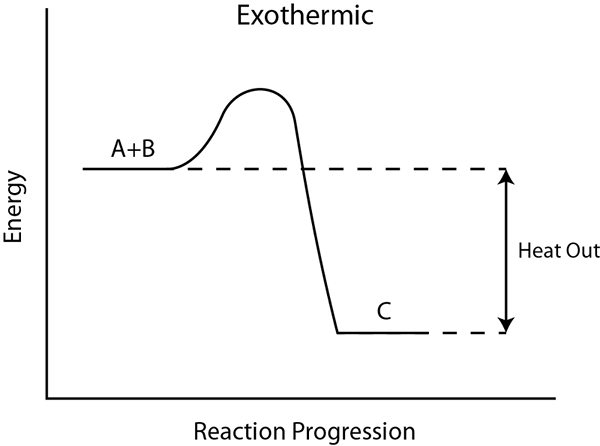
Lorsque vous envisagez la plupart des gaz, la dissolution est exothermique. Lorsqu'un gaz se dissout dans un liquide, l'énergie est libérée sous forme de chaleur en réchauffant à la fois la solution et l'environnement. La température de la solution a tendance à diminuer éventuellement, correspondant à la température de l'environnement. De plus, si nous chauffons une solution saturée d'un gaz, le gaz a tendance à sortir de la solution.
Qu'est-ce que la chaleur de réaction?
La chaleur de réaction ou l'enthalpie de réaction est la différence entre le réactif total et les enthalpies molaires totales du produit qui sont calculées pour les substances chimiques à l'état standard. Cette valeur d'enthalpie est utile pour prédire l'énergie totale de liaison chimique qui est libérée ou liée pendant la réaction chimique. Ici, nous devons également tenir compte de l'enthalpie du mélange.
Dans la détermination de la chaleur de réaction, l'état standard peut être défini pour toute température et valeur de pression, et la valeur doit être spécifiée pour cette température et cette pression particulières, mais les valeurs sont généralement données à 25 degrés Celsius et une pression de 1 atm et une pression.

Lorsque vous envisagez les ions dans une solution aqueuse, nous pouvons choisir l'état standard, étant donné que la concentration aqueuse d'ions H + de 1 mol / L a une enthalpie standard nulle. Cela permet de tabuler les enthalpies standard pour les cations et les anions à une concentration standard similaire.
Quelle est la différence entre la chaleur de solution et la chaleur de réaction?
La chaleur de la solution et la chaleur de réaction sont des valeurs d'enthalpie importantes en chimie physique qui sont utiles dans la détermination des propriétés des solutions et des réactions chimiques. La principale différence entre la chaleur de la solution et la chaleur de réaction est que la chaleur de solution est la quantité d'énergie thermique libérée ou absorbée par un système chimique lors de la formation d'une solution, tandis que la chaleur de réaction est la différence entre le réactif total et les enthalpies molaires totales du produit qui sont calculés pour les substances chimiques à l'état standard.
L'infographie ci-dessous répertorie les différences entre la chaleur de la solution et la chaleur de réaction sous forme tabulaire pour la comparaison côte à côte.
Résumé - chaleur de solution vs chaleur de réaction
La chaleur de la solution et la chaleur de réaction sont des valeurs d'enthalpie importantes en chimie physique qui sont utiles dans la détermination des propriétés des solutions et des réactions chimiques. La principale différence entre la chaleur de la solution et la chaleur de réaction est que la chaleur de solution est la quantité d'énergie thermique libérée ou absorbée par un système chimique lors de la formation d'une solution, tandis que la chaleur de réaction est la différence entre le réactif total et les enthalpies molaires totales du produit qui sont calculés pour les substances chimiques à l'état standard.
Référence:
1. «Formule de réaction de la chaleur - définition, équation et exemples résolus."Byju's, 15 septembre. 2020.
Image gracieuseté:
1. «Réaction exothermique» par Brazosport College - Propre travaux (CC BY-SA 3.0) via Commons Wikimedia


