Quelle est la différence entre l'acide peracétique et le peroxyde d'hydrogène
Le différence clé entre l'acide peracétique et le peroxyde d'hydrogène est que l'acide peracétique est une solution organique qui peut produire de l'acide acétique comme sous-produit des processus d'oxydation, tandis que le peroxyde d'hydrogène est une solution aqueuse inorganique qui peut former l'eau lors de l'oxydation.
L'acide peracétique et le peroxyde d'hydrogène sont des composés très actifs qui ont de nombreuses applications importantes industriellement et dans les ménages également.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'acide peracétique
3. Qu'est-ce que le peroxyde d'hydrogène
4. Acide peracétique vs peroxyde d'hydrogène sous forme tabulaire
5. Résumé - acide peracétique vs peroxyde d'hydrogène
Qu'est-ce que l'acide peracétique?
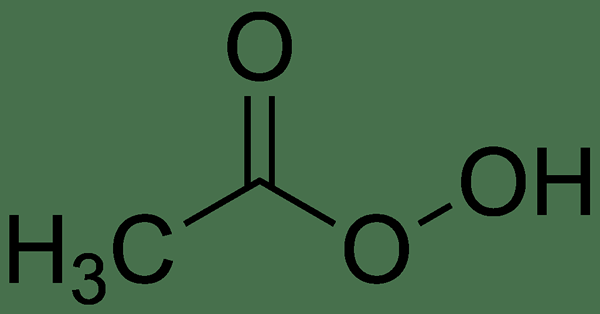
L'acide peracétique est un composé organique ayant la formule chimique CH3CO3H. C'est un peroxyde organique qui existe comme un liquide incolore ayant une odeur âcre caractéristique. C'est un acide fort qui peut être hautement corrosif. L'acide peracétique est également connu sous le nom acide peroxyacétique. Cependant, c'est un acide plus faible par rapport à l'acide acétique.

Figure 01: La structure chimique de l'acide peracétique
Ce composé acide peut être produit par l'autoxydation de l'acétaldéhyde industriellement. Dans ce processus, l'acide se forme sur le traitement de l'acide acétique avec du peroxyde d'hydrogène en présence d'un catalyseur acide fort. Alternativement, nous pouvons produire cet acide par la réaction entre le chlorure d'acétyle et l'anhydride acétique, qui est une réaction utile pour générer une solution d'acide peracétique ayant une faible teneur en eau.
Il existe plusieurs utilisations importantes de l'acide peracétique, notamment en l'utilisant comme antimicrobien sur les surfaces dures intérieures, une application de désinfection à des fins médicales, utile pour l'époxydation de différents alcènes, etc.
Qu'est-ce que le peroxyde d'hydrogène?
Le peroxyde d'hydrogène est un composé inorganique ayant la formule chimique H2O2. Dans sa forme pure, le peroxyde d'hydrogène a une couleur bleu pâle, et il existe comme un liquide clair. De plus, ce liquide est légèrement plus visqueux que l'eau. En fait, c'est le peroxyde le plus simple parmi tous les composés de peroxyde.
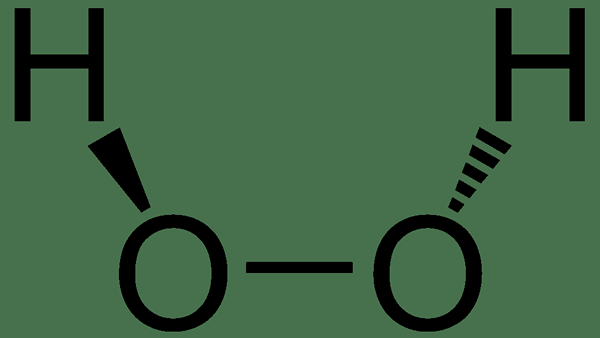
Figure 02: La structure chimique du peroxyde d'hydrogène
Il existe des applications importantes du peroxyde d'hydrogène; Parmi eux, les principales applications incluent l'utiliser comme oxydant, agent de blanchiment et antiseptique. Il existe une liaison de peroxyde instable entre deux atomes d'oxygène dans ce composé; Ainsi, le composé est très réactif. Par conséquent, il se décompose lentement lorsqu'il est exposé à la lumière. De plus, nous devons stocker ce composé avec un stabilisateur dans une solution faiblement acide.
La masse molaire de peroxyde d'hydrogène est 34.014 g / mol. Le peroxyde d'hydrogène a une odeur légèrement pointue. Son point de fusion est −0.43 ° C, et son point d'ébullition est 150.2 ° C. Cependant, si nous faisons bouillir du peroxyde d'hydrogène à ce point d'ébullition, pratiquement, il subit une décomposition thermique explosive. De plus, ce composé est miscible avec de l'eau car il peut former des liaisons hydrogène. Là, il forme un mélange eutectique avec de l'eau (un mélange homogène qui fond ou se solidifie à une seule température). Ce mélange montre une dépression de point de congélation.
Quelle est la différence entre l'acide peracétique et le peroxyde d'hydrogène?
L'acide peracétique et le peroxyde d'hydrogène sont des composés très actifs qui ont de nombreuses applications importantes dans les industries et les ménages. La principale différence entre l'acide peracétique et le peroxyde d'hydrogène est que l'acide peracétique est une solution organique qui peut produire de l'acide acétique comme sous-produit des processus d'oxydation, tandis que le peroxyde d'hydrogène est une solution aqueuse inorganique qui peut former l'eau lors de l'oxydation.
L'infographie ci-dessous présente les différences entre l'acide peracétique et le peroxyde d'hydrogène sous forme tabulaire pour une comparaison côte à côte.
Résumé - acide peracétique vs peroxyde d'hydrogène
L'acide peracétique est un composé organique ayant la formule chimique CH3CO3H, tandis que le peroxyde d'hydrogène est un composé inorganique ayant la formule chimique H2O2. La principale différence entre l'acide peracétique et le peroxyde d'hydrogène est que l'acide peracétique est une solution organique qui peut produire de l'acide acétique comme sous-produit des processus d'oxydation, tandis que le peroxyde d'hydrogène est une solution aqueuse inorganique qui peut former l'eau lors de l'oxydation.
Référence:
1. «Directives de désinfection et de stérilisation." Centres pour le Contrôle et la Prévention des catastrophes, Centers for Disease Control and Prevention, 24 mai 2019.
Image gracieuseté:
1. «Ethaneperoxoic Acid 200» par Emeldir (Talk) - Propre travaux (domaine public) via Commons Wikimedia
2. «WASSERSERSOFFPEROXID» par NeuroKer - Propre travaux (domaine public) via Commons Wikimedia


