Quelle est la différence entre IgG IgM Iga IgE et IGD
Le différence clé Entre IgG IgM Iga IGE et IGD est le type de chaîne lourde dans chaque anticorps. Alors que l'IgG a un type de chaîne lourde γ, IgM a un type de chaîne lourde. En revanche, l'IgA a un type α de chaîne lourde, l'IgE a un type de chaîne lourde ε et l'IGD a un type de chaîne lourde.
La production d'anticorps a lieu en réponse à un antigène dans le cadre de l'activation des mécanismes immunitaires adaptatifs chez les animaux de niveau supérieur. L'interaction anticorps-antigène active des réactions telles que l'agglutination, la neutralisation, l'opsonisation, l'activation du complément et l'activation des cellules B qui participent à la facilitation d'un mécanisme de réponse immunitaire contre un organisme étranger. Les anticorps varient dans leurs aspects structurels et fonctionnels.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'IgG
3. Qu'est-ce que IGM
4. Qu'est-ce que Iga
5. Qu'est-ce que IgE
6. Qu'est-ce que Igd
7. Similitudes - IgG IgM Iga IgE et IGD
8. IgG vs IgM vs Iga vs IGE vs Igd sous forme tabulaire
9. Résumé - IgG vs IgM vs Iga vs IGE vs IGD
Qu'est-ce que l'IgG?
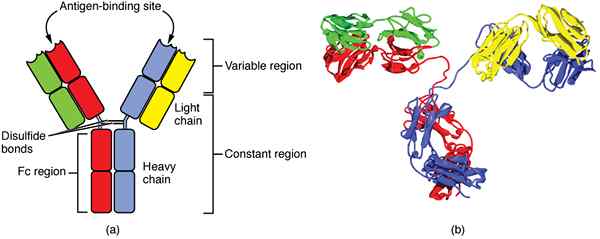
L'immunoglobuline G ou l'IgG est la classe la plus courante d'immunoglobuline qui est présente en grande quantité dans les liquides tissulaires et le sang. Il a une concentration sérique de plus de 75%. Le poids moléculaire des IgG est de 150 000 jours. L'IgG est un monomère, et les lourdes chaînes d'IgG appartiennent au type γ.

Figure 01: Structures 2D et 3D d'IgG
Il y a deux sites de liaison à l'antigène. Les sous-classes d'IgG incluent IgG1, IgG2, IgG3 et IgG4. L'IgG est le seul type d'immunoglobuline qui peut traverser le placenta. L'IgG participe à l'induction de la protection immunitaire depuis la petite enfance comme IgG est également transmise de mère à bébé pendant la lactation. La fonction clé de l'IgG est de participer à l'opsonisation et à la neutralisation des réactions immunitaires. Il participe également à l'activation des réponses secondaires pendant les réactions immunitaires.
Qu'est-ce que IGM?
L'immunoglobuline M ou IgM a une structure de pentamère unique et est donc le plus grand type d'anticorps. Ayant un poids moléculaire d'environ 900 000 jours, il représente près de 10% de l'anticorps total dans le sérum. La structure unique du pentamère facilite 10 sites de liaison à l'antigène. Les chaînes lourdes d'IgM sont composées du type μ. Il a également une liaison disulfure caractéristique reliant chaque monomère.
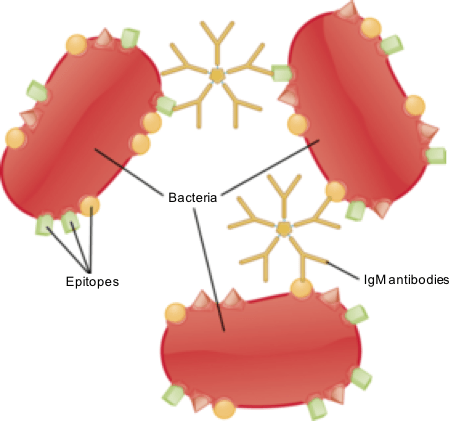
Figure 02: Activation IgM dans les infections bactériennes
La fonction principale de l'IGM est d'activer la réponse immunitaire primaire. C'est aussi un bon activateur du système de complément et participe à l'agglutination. Par conséquent, l'IGM joue un rôle important dans les infections bactériennes.
Qu'est-ce que Iga?
L'immunoglobuline A ou l'IGA est un anticorps dimérique qui contient un élément spécial appelé élément sécrétoire. En raison de son arrangement structurel, le poids moléculaire est supérieur à celui des classes d'anticorps qui ont des structures monomères. C'est 385 000.00 D. Il a 4 sites de liaison à l'antigène avec des chaînes lourdes composées du type α. Il a deux sous-classes: IGA1 et IGA2.
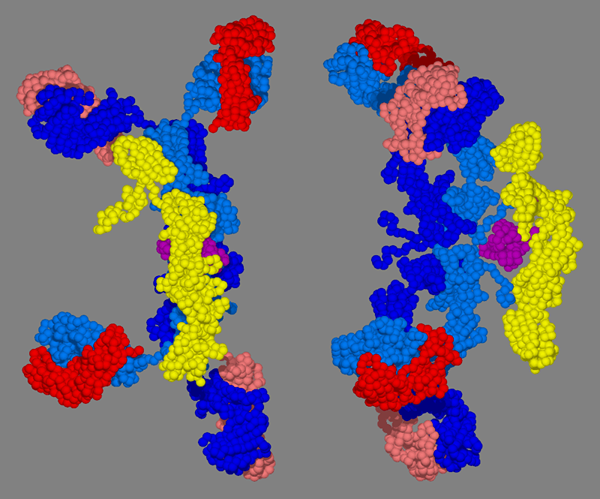
Figure 03: Structure 3D de l'IGA
En raison de sa capacité à agir comme un élément sécrétoire, ce type d'anticorps se trouve principalement dans les sécrétions corporelles telles que les larmes, la salive, les sécrétions respiratoires et intestinales et les sécrétions muqueuses. De plus, il est également présent dans Colostrum. Environ 15% de l'anticorps sérique total est responsable de la classe des anticorps IgA. IGA ne participe pas à l'activation du système de complément; Cependant, sa fonction principale doit s'exprimer dans le tissu, empêchant la colonisation d'organismes étrangers tels que les bactéries.
Qu'est-ce que IgE?
L'immunoglobuline E ou IgE est le type d'immunoglobuline qui se trouve le moins dans le sérum. Il représente moins de 0.01% du total des immunoglobulines sériques. Sa structure est monomère, et la chaîne lourde est composée du type ε. De plus, son poids moléculaire est d'environ 200 000 jours. IGE a deux sites de liaison à l'antigène similaires à celui de l'IgG.
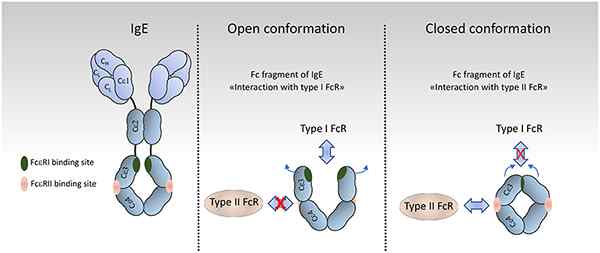
Figure 04: Différentes confirmations d'IgE
La fonction principale de l'IgE est d'activer les réactions d'allergies en réponse à des conditions comme l'asthme et le rhume des foins. Dans un aspect plus large, l'activation de l'IgE est observée lors des réactions d'hypersensibilité de type I. En réponse à l'interaction anticorps-antigène, la sécrétion d'histamines est favorisée. Il n'a pas la capacité d'activer le système de complément. Il joue également un rôle dans la défense contre les infections parasitaires.
Qu'est-ce que Igd?
L'immunoglobuline D ou l'IGD est également une immunoglobuline monomère qui n'a que 2 sites de liaison à l'antigène. Il a le poids moléculaire le plus bas, environ 185 000 jours. Igd explique environ <0.5% of the total antibody concentration in the serum. The heavy chain is composed of the δ type. The role of IgD is not highly specific, but they mainly take part in activating B cells during the adaptive immune response. They do not activate the complement system. They are unable to cross the placenta.
Quelles sont les similitudes entre IgG IGM IgA IgE et IGD?
- Tous sont composés de chaînes lourdes et de chaînes légères.
- Ce sont des glycoprotéines.
- De plus, tous les types d'anticorps pourraient faciliter la liaison des anticorps.
- De plus, la liaison à l'antigène anticorps est facilitée en raison de la présence de sites de liaison à l'antigène dans tous les anticorps.
- Ils sont présents dans le sérum.
- Tous participent à l'activation des réponses immunitaires adaptatives.
- Tous les anticorps peuvent être détectés en utilisant des techniques immunitaires comme le test radio immuno (RIA) ou le test immuno-enzymatique (ELISA) (ELISA).
- Ils jouent un rôle important dans le diagnostic et la pathologie.
Quelle est la différence entre IgG IgM Iga IgE et IGD?
La principale différence entre IgG IgM IgA IgE et Igd est le type de chaîne lourde que chaque type d'anticorps possède. L'IgG a le type γ de chaîne lourde; IgM a le type de chaîne lourde μ; L'IgA a un type α de chaîne lourde; IgE a un type de chaîne lourde ε, et Igd a un type de chaîne lourde. De plus, leurs arrangements structurels varient également, entraînant des poids moléculaires variés pour chaque type d'anticorps. De plus, la manière dont chaque anticorps agit varie également. Bien que l'IgG et l'IGM puissent activer le système de complément, les autres types d'anticorps ne sont pas capables de le faire. De plus, seuls les IgG peuvent traverser le placenta.
L'infographie ci-dessous présente les différences entre IgG IgM IgA IgE et Igd sous forme tabulaire pour une comparaison côte à côte.
Résumé - IgG vs IgM vs Iga vs IGE vs IGD
Les anticorps sont dérivés des cellules B, et ils jouent un rôle important dans l'immunité adaptative. Il existe cinq classes principales d'anticorps qui diffèrent principalement en fonction du type de chaîne lourde qu'ils possèdent. IgG IgM IgA IgE et IgD ont des types γ, μ, α, ε et Δ de chaînes lourdes, respectivement. De plus, ils diffèrent également dans leurs structures car les IgG, les IgE et les IgD atteignent des structures monomères, IgM atteint une structure pentamérique et l'IgA atteint une structure dimérique. La façon dont ils activent les réponses immunitaires est également différente entre les différentes classes d'anticorps. Les IgG et les IGM sont capables d'activer le système de complément, mais les autres types ne sont pas. C'est donc le résumé de la différence entre IgG IgM Iga IGE et IGD.
Référence:
1. Schroeder, Harry W et Lisa Cavacini. «Structure et fonction des immunoglobulines.»Le Journal of Allergy and Clinical Immunology, U.S. Bibliothèque nationale de médecine, février. 2010.
2. Vaillant, ange a. Justing. «Immunoglobuline.»StatPearls. U.S. Bibliothèque nationale de médecine, 12 octobre. 2021.
Image gracieuseté:
1. «2220 Structure à quatre chaînes d'un anticorps générique-structures IgG2» par OpenStax College - Anatomy & Physiology, Connexions Web Site. 19 juin 2013. (CC par 3.0) via Commons Wikimedia
2. «Les anticorps d'immunoglobuline (IgM) se liant aux épitopes d'antigène adjacents à la surface des cellules bactériennes» par SA1590 - propre travail (CC BY-SA 4.0) via Commons Wikimedia
3. «Structure 3D de la sécrétion IGA2» par McORTNGHH - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia
4. «MODE DE FONCTIONNEMENT DU RÉCEPTEUR FC AVEC UNE Immunoglobuline E» par Ben Mkaddem Sanae, Benhamou Marc, Monteiro Renato C.Comprendre l'implication des récepteurs du FC dans les maladies inflammatoires: des mécanismes aux nouveaux outils thérapeutiques. Frontiers in Immunology 10.2019, page 811 (CC BY-SA 4.0) via Commons Wikimedia


