Quelle est la différence entre la loi de Gay-Lussac et la loi d'Avogadro
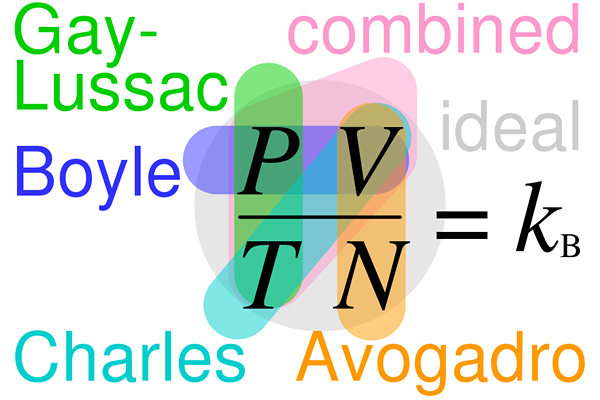
Le Différence clé entre la loi de Gay-Lussac et la loi d'Avogadro Est-ce que la loi de Gay-Lussac indique que le volume d'un gaz est directement proportionnel à la température du gaz, tandis que la loi d'Avogadro indique que le volume d'un gaz est directement proportionnel au nombre de molécules dans le gaz.
La loi de Gay-Lussac décrit la variation de la pression d'une masse particulière d'un gaz directement avec la température absolue du gaz en volume constant. La loi d'Avogadro est une loi expérimentale sur le gaz qui stipule que le volume d'un gaz est lié à la quantité de substance gazeuse présente dans un échantillon donné.
CONTENU
1. Aperçu et différence clé
2. Quelle est la loi de Gay-Lussac
3. Quelle est la loi d'Avogadro
4. Loi de Gay-Lussac contre la loi d'Avogadro sous forme tabulaire
5. Résumé - La loi de Gay-Lussac contre la loi d'Avogadro
Quelle est la loi de Gay-Lussac?
La loi de Gay-Lussac décrit la variation de la pression d'une masse particulière d'un gaz directement avec la température absolue du gaz en volume constant. Il s'appelle parfois la loi d'Amonton. Nous pouvons donner une expression mathématique pour cette loi comme suit:
P / t = k
Dans cette équation, P fait référence à la pression, t se réfère à la température absolue et k est une constante. On peut dire que c'est un cas particulier de droit du gaz idéal.
Un dérivé de cette loi est la loi de pression-température, qui décrit la relation entre la pression et la température d'une certaine masse d'un gaz à un volume constant.
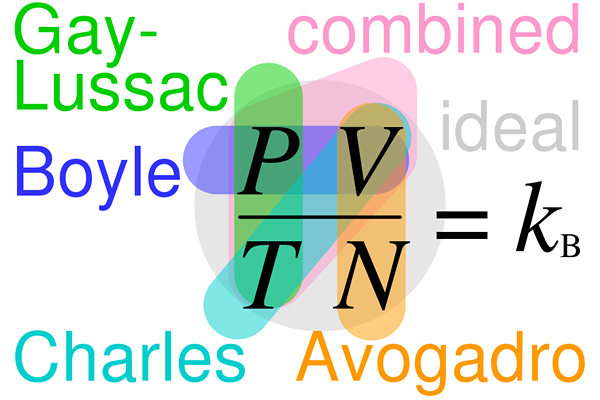
Selon la loi de la combinaison de volumes, les gaz réagissent les uns avec les autres au moyen du volume, et ils réagissent dans un rapport de nombre entier simple à la température constante et aux conditions de pression constantes. En d'autres termes, le rapport entre les volumes des gaz réactifs et les produits gazeux peut être donné en nombres entiers simples. Gay Lussac a été l'un des premiers scientifiques à découvrir cette relation, ce qui a conduit à la dérivation de la loi d'Avogadro.
Quelle est la loi d'Avogadro?
La loi d'Avogadro est une loi expérimentale sur le gaz qui stipule que le volume d'un gaz est lié à la quantité de substance gazeuse présente dans un échantillon donné. Il s'appelle également l'hypothèse d'Avogadro ou le principe d'Avogadro. Ceci est une forme spécifique de droit du gaz idéal. Cette loi a été nommée d'après Amedeo Avogadro en 1812.
Selon les descriptions modernes, la loi d'Avogadro stipule que les volumes égaux de tous les gaz qui sont dans une température égale et une condition de pression ont le même nombre de molécules. Par exemple, des volumes égaux d'hydrogène gazeux et d'azote gazeux sont constitués d'un nombre égal d'atomes lorsque ces deux gaz sont dans la même température et la même pression. Pratiquement, les gaz réels montrent de petits écarts par rapport au comportement de gaz idéal où la loi ne tient qu'approximativement précis. Cependant, c'est toujours une approximation importante pour les scientifiques. Mathématiquement, la loi est la suivante:
V / n = k
Où v est le volume du gaz, n est la quantité de substance du gaz dans l'échantillon, et k est une valeur constante donnée pour une température et une pression particulières.
Différence entre la loi de Gay-Lussac et la loi d'Avogadro
La loi de Gay-Lussac et la loi d'Avogadro sont deux lois sur le gaz importantes. La principale différence entre la loi de Gay-Lussac et la loi d'Avogadro est que la loi de Gay-Lussac indique que le volume d'un gaz est directement proportionnel à la température du gaz, tandis que la loi d'Avogadro stipule que le volume d'un gaz est directement proportionnel au nombre de molécules dans le gaz.
Le tableau suivant résume la différence entre la loi de Gay-Lussac et la loi d'Avogadro.
Résumé - La loi de Gay-Lussac contre la loi d'Avogadro
La loi de Gay-Lussac et la loi d'Avogadro sont deux lois sur le gaz importantes. La principale différence entre la loi de Gay-Lussac et la loi d'Avogadro est que la loi de Gay-Lussac indique que le volume d'un gaz est directement proportionnel à la température du gaz, tandis que la loi d'Avogadro stipule que le volume d'un gaz est directement proportionnel au nombre de molécules dans le gaz.
Référence:
1. «La loi de Gay-Lussac - déclaration, formule, explication détaillée." ByJus, 25 mars. 2021.
Image gracieuseté:
1. «Relations idéales de droit du gaz» par CMGLEE - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia


