Quelle est la différence entre le nitrate d'ammonium et le sulfate d'ammonium
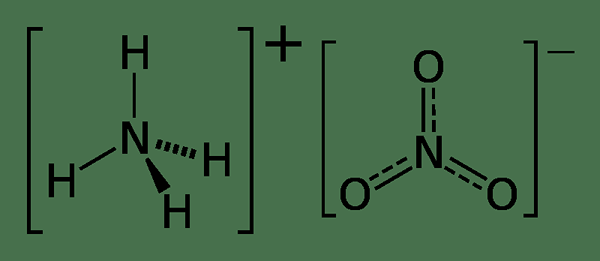
Le différence clé entre le nitrate d'ammonium et le sulfate d'ammonium est que le nitrate d'ammonium se forme à partir de la réaction entre l'ammoniac et l'acide nitrique, tandis que le sulfate d'ammonium se forme à partir de la réaction entre l'ammoniac et l'acide sulfurique.
Le nitrate d'ammonium est un composé inorganique ayant la formule chimique NH4NO3, et le sulfate d'ammonium est un composé inorganique ayant la formule chimique (NH4) 2SO4. Ce sont les deux sels d'ammoniac avec une odeur forte et irritante.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le nitrate d'ammonium
3. Qu'est-ce que le sulfate d'ammonium
4. Nitrate d'ammonium vs sulfate d'ammonium sous forme tabulaire
5. Résumé - Nitrate d'ammonium vs sulfate d'ammonium
Qu'est-ce que le nitrate d'ammonium?
Le nitrate d'ammonium est un composé inorganique ayant la formule chimique NH4NO3. Cette substance est un sel composé d'un cation ammonium et d'un anion nitrate. De plus, il apparaît comme un solide blanc à température ambiante, et il peut facilement se dissoudre dans l'eau. De plus, le nitrate d'ammonium se produit comme un minéral naturel de nature.
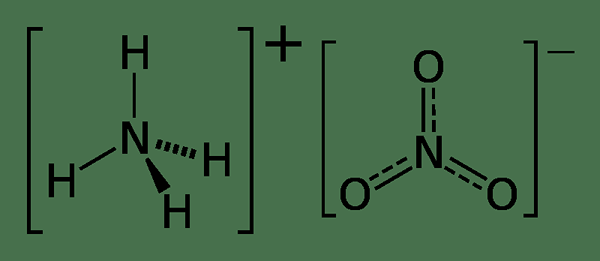
Figure 01: La structure chimique du nitrate d'ammonium
Certains faits chimiques sur ce composé sont les suivants:
- La masse molaire est de 80.043 g / mol
- Apparaît comme un solide blanc ou gris
- Le point de fusion est 169.6 ° C
- Au-dessus de 210 ° C, il se décompose
- La structure cristalline du composé est trigonale
L'utilisation principale du composé de nitrate d'ammonium peut être trouvée dans l'agriculture; Il est très utile en tant qu'engrais à haute azote. En dehors de cela, nous pouvons l'utiliser pour produire des mélanges explosifs à des fins d'extraction et de carrière. Étant donné que la dissolution de ce composé dans l'eau est très endothermique, elle est utile dans certains packs froids instantanés également.
Qu'est-ce que le sulfate d'ammonium?
Le sulfate d'ammonium est un composé inorganique ayant la formule chimique (NH4) 2SO4. Il se compose généralement d'un cation ammonium lié à un anion sulfate. Par conséquent, ce composé a deux cations d'ammonium par anion sulfate. C'est un sel inorganique de sulfate avec de nombreuses utilisations importantes.
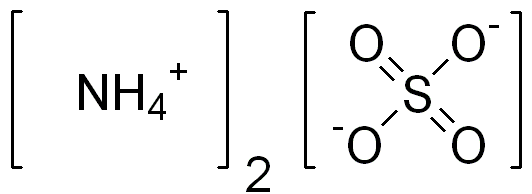
Figure 02: La structure chimique du sulfate d'ammonium
La masse molaire du sulfate d'ammonium est 132.14 g / mol. Ce composé apparaît comme des granules ou des cristaux hygroscopiques fins. De plus, le point de fusion de ce composé peut aller de 235 à 280 ° C; Au-dessus de cette plage de température, le composé a tendance à se décomposer. Nous pouvons produire des composés de sulfate d'ammonium en traitant l'ammoniac avec de l'acide sulfurique. Pour cette préparation, nous pouvons utiliser un mélange de gaz d'ammoniac et de vapeur d'eau dans un réacteur. De plus, nous devons ajouter de l'acide sulfurique concentré dans ce réacteur, puis la réaction entre ces composants formera du sulfate d'ammonium.
Lorsque vous envisagez les applications du sulfate d'ammonium, nous pouvons l'utiliser comme engrais, principalement pour les sols alcalins. De plus, nous pouvons l'utiliser dans la production d'insecticides, d'herbicides, de fongicides, etc. En plus de ceux-ci, nous utilisons ce composé pour la purification des protéines via les précipitations dans le laboratoire de biochimie. Il est également utile comme additif alimentaire.
Quelle est la différence entre le nitrate d'ammonium et le sulfate d'ammonium?
Le nitrate d'ammonium et le sulfate d'ammonium sont des sels d'ammonium. La principale différence entre le nitrate d'ammonium et le sulfate d'ammonium est que le nitrate d'ammonium se forme à partir de la réaction entre l'ammoniac et l'acide nitrique, tandis que le sulfate d'ammonium se forme à partir de la réaction entre l'ammoniac et l'acide sulfurique. De plus, le nitrate d'ammonium est disponible sous forme d'un solide en cristal blanc, tandis que le sulfate d'ammonium est disponible en poudre fine, granules ou cristaux.
L'infographie ci-dessous présente les différences entre le nitrate d'ammonium et le sulfate d'ammonium sous forme tabulaire pour une comparaison côte à côte.
Résumé - Nitrate d'ammonium vs sulfate d'ammonium
Le nitrate d'ammonium est un composé inorganique ayant la formule chimique NH4NO3, tandis que le sulfate d'ammonium est un composé inorganique ayant la formule chimique (NH4) 2SO4. La principale différence entre le nitrate d'ammonium et le sulfate d'ammonium est que le nitrate d'ammonium se forme à partir de la réaction entre l'ammoniac et l'acide nitrique, tandis que le sulfate d'ammonium se forme à partir de la réaction entre l'ammoniac et l'acide sulfurique.
Référence:
1. "Nitrate d'ammonium." Centre national d'information sur la biotechnologie. Base de données de composés PubChem, U.S. Bibliothèque nationale de médecine.
Image gracieuseté:
1. «Ammonium-nitrate-2d» par Mikayé - propre travail basé sur: ammonium-nitrate-2d.PNG (domaine public) via Commons Wikimedia
2. «Sulfate d'ammonium» par Edgar181 - Propre travaux (domaine public) via Commons Wikimedia


