Quelle est la différence entre l'acétylacétone et l'ion acétylacétonate
Le différence clé entre l'acétylacétone et l'ion acétylacétonate est que l'acétylacétone est un composé organique qui appartient à la catégorie 1,3-dikétone, tandis que l'ion acétylacétonate est l'anion dérivé du composé organique de l'acétylacétonate.
L'acétylacétone est un composé organique ayant la formule chimique CH3COCH2COCH3. L'ion acétylacétonate est une espèce chimique chargée négativement dérivée de l'acétylacétone. Nous pouvons classer ces deux espèces chimiques en fonction de leurs charges formelles; L'acétylacétonate a une charge formelle nulle tandis que l'ion acétylacétonate a une charge négative -1.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'acétylacétone
3. Qu'est-ce que l'ion acétylacétonate
4. Acétylacétone vs ion acétylacétonate sous forme tabulaire
5. Résumé - acétylacétone vs acétylacétonate ion
Qu'est-ce que l'acétylacétone?
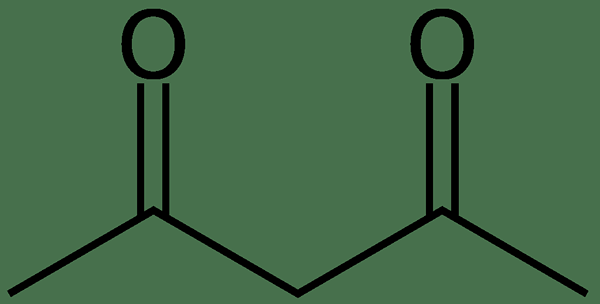
L'acétylacétone est un composé organique ayant la formule chimique CH3COCH2COCH3. Il se produit comme un liquide incolore, et nous pouvons classer ce composé comme un 1,3-diketone. En règle générale, ce composé existe en équilibre avec la forme tautomère. De plus, l'acétylacétone est le précurseur de l'anion acétylacétonate, qui est un ligand bidenté. De plus, il sert de bloc de construction pour la synthèse des composés hétérocycliques. L'acétylacétone est un acide faible.

Figure 01: La structure chimique de l'actyacétone
De plus, les tautomères céto et énols de l'acétylacétone ont tendance à coexister en solution. Sous la forme énol, l'atome d'hydrogène est partagé également entre les deux atomes d'oxygène. Nous pouvons distinguer les deux formes tautomériques par spectroscopie RMN, spectroscopie IR et autres méthodes.
De plus, la constante d'équilibre est élevée dans les solvants non polaires, où la forme céto devient plus favorable dans les solvants polaires de liaison hydrogène, y compris l'eau. En revanche, la forme énol est l'analogue vinylogue d'un acide carboxylique.
Nous pouvons préparer ce composé industriellement à travers le réarrangement thermique de l'acétate d'isopropényle. Cependant, dans les laboratoires, nous pouvons commencer cette préparation avec de l'acétone et de l'anhydride acétique en présence de catalyseur de trifluoride de bore.
Qu'est-ce que l'ion acétylacétonate?
L'ion acétylacétonate est une espèce chimique chargée négativement dérivée de l'acétylacétone. La charge officielle sur cet anion est -1. Cet anion peut agir comme un ligand bidenté pour une formation complexe en chimie de coordination. Il y a deux atomes d'oxygène dans cet anion ayant des paires d'électrons solitaires qui peuvent être données à un centre de cations métalliques approprié. Par conséquent, l'anion acétylacétonate est important dans la chimie de la coordination en tant que ligand.

Étant donné que l'acétylacétone est un acide faible, il a tendance à exister en équilibre avec sa base conjuguée et libérer le proton lorsqu'il est en solution aqueuse. La base conjuguée de cet acide est l'anion acétylacétonate. Cet anion est attiré par les cations métalliques en raison des forces d'attraction de charge opposées.
Quelle est la différence entre l'acétylacétone et l'ion acétylacétonate?
L'acétylacétone est un composé organique ayant la formule chimique CH3COCH2COCH3, tandis que l'ion acétylacétonate est une espèce chimique chargée négativement dérivée de l'acétylacétone. Par conséquent, la principale différence entre l'acétylacétone et l'ion acétylacétonate est que l'acétylacétone est un composé organique qui appartient à la catégorie 1,3-dikétone, tandis que l'ion acétylacétonate est l'anion dérivé de l'acétylacétonate de composé organique. Le composé de l'acétylacétone a une charge formelle nulle, tandis que l'ion acétylacétonate a une charge formelle de -1.
Vous trouverez ci-dessous un résumé de la différence entre l'acétylacétone et l'ion acétylacétonate sous forme tabulaire pour une comparaison côte à côte.
Résumé - acétylacétone vs acétylacétonate ion
Les ions acétylacétone et acétylacétonate sont des espèces chimiques apparentées car l'ion acétylacétonate est formé à partir de l'élimination des protons des composés de l'acétylacétone. La principale différence entre l'acétylacétone et l'ion acétylacétonate est que l'acétylacétone est un composé organique qui appartient à la catégorie 1,3-dikétone, tandis que l'ion acétylacétonate est l'anion dérivé de l'acétylacétonate de composé organique.
Référence:
1. «L'acétylacétonate." Un aperçu | Sujets ScienceDirect.
2. «L'acétylacétonate." Structures avec des ligands bidentés.
3. «Acétylacétone." Centre national d'information sur la biotechnologie. Base de données de composés PubChem, U.S. Bibliothèque nationale de médecine.
Image gracieuseté:
1. «Acetyloaceton» par Arrowsmaster - Propre travaux (domaine public) via Commons Wikimedia
2. «CNX Chem 19 02 Couleurs» par OpenStax - (CC par 4.0) via Commons Wikimedia


