Différence entre le mélange de zinc et la structure du diamant
Le différence clé entre le mélange de zinc et la structure du diamant est que Le mélange de zinc a des atomes de zinc et de soufre dans sa structure tandis que la structure du diamant n'a que des atomes de carbone dans sa structure.
La structure des cristaux de mélange de zinc ressemble étroitement à la structure du diamant. Ces deux structures sont des systèmes cristallins cubiques, mais ils ont des atomes différents dans leurs cellules unitaires. Ainsi, il y a une différence entre le mélange de zinc et la structure du diamant.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le zinc mélange
3. Qu'est-ce que la structure du diamant
4. Comparaison côte à côte - Structure du mélange de zinc vs diamant sous forme tabulaire
5. Résumé
Quel zinc mélange?
Le mélange de zinc est le nom de la structure cristalline cubique du sulfure de zinc (ZNS). C'est un réseau de type diamant. De plus, il est thermodynamiquement plus favorisé que d'autres formes de sulfure de zinc comme le wurtzite. Cependant, il peut changer sa structure en modifiant la température. Par exemple, le mélange de zinc peut devenir du wurtzite si nous modifions la température.

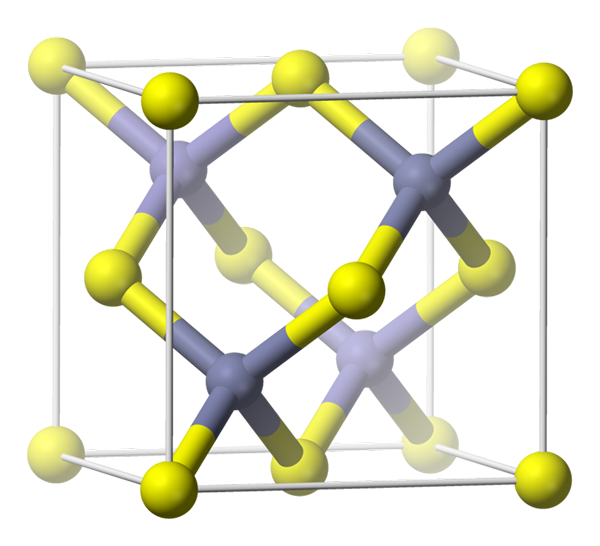
Figure 01: cellule unitaire du mélange de zinc
Nous pouvons caractériser le mélange de zinc comme une structure cubique centrée sur le visage cubique et une structure cubique centrée sur le visage (FCC). De plus, cette structure est plus dense que la structure de wurtzite. Cependant, lorsque la température augmente, la densité a tendance à diminuer; Par conséquent, une conversion peut avoir lieu de Zinc Blende à Wurtzite. De plus, les cations de cette structure (ions de zinc) occupent l'un des deux types de trous tétraédriques présents dans la structure, et il a quatre unités asymétriques dans sa cellule unitaire.
Qu'est-ce que la structure du diamant?
Le diamant est un allotrope de carbone. C'est une forme solide de carbone qui a une forme tridimensionnelle. De plus, chaque atome de carbone est attaché à quatre autres atomes de carbone via une liaison chimique covalente. Cette structure cristalline est appelée une structure «diamant cubique».
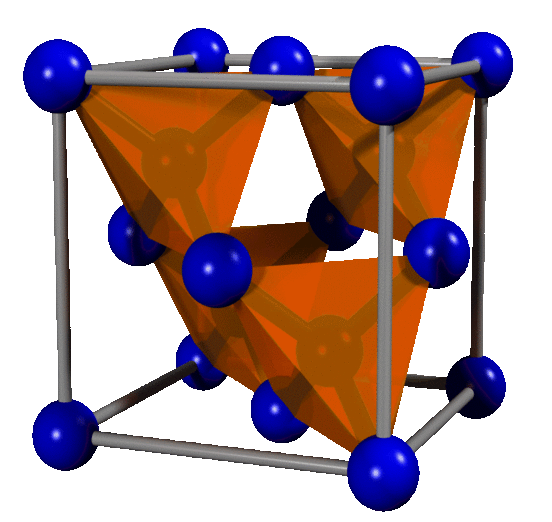
Figure 02: cellule unitaire de diamant
De plus, parmi tous les matériaux naturels, ce composé a la dureté et la conductivité thermique la plus élevée. Par conséquent, le diamant est couramment utilisé dans les industries pour la coupe et le polissage.
Quelle est la différence entre le mélange de zinc et la structure du diamant?
Le mélange de zinc et le diamant ont des structures étroitement liées. La principale différence entre le mélange de zinc et la structure du diamant est que le mélange de zinc a à la fois des atomes de zinc et de soufre dans sa structure tandis que la structure du diamant n'a que des atomes de carbone dans sa structure. De plus, deux atomes dans la base du réseau cubique centré sur le visage de Zinc Bende sont identiques tandis que les deux atomes dans la base du réseau cubique centré sur le visage de la structure du diamant sont différents les uns des autres.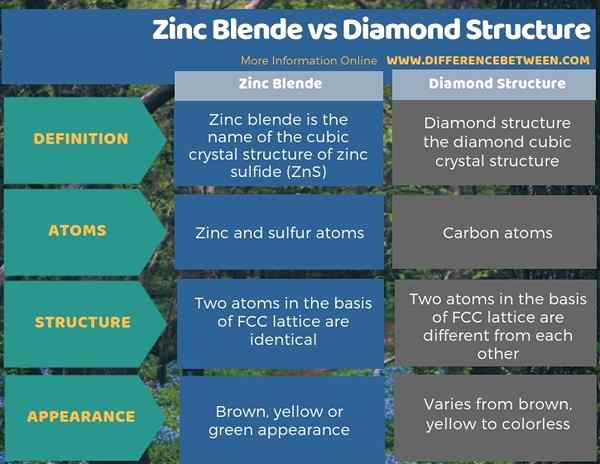
Résumé - Structure du zinc mélange vs diamant
Le mélange de zinc et le diamant ont des structures étroitement liées. La principale différence entre le mélange de zinc et la structure du diamant est que le mélange de zinc a à la fois des atomes de zinc et de soufre dans sa structure tandis que la structure du diamant n'a que des atomes de carbone dans sa structure.
Référence:
1.Helmenstine, Anne Marie. «Propriétés et types de diamants."Thoughtco, mar. 25, 2019, disponible ici.
Image gracieuseté:
1. «Diamond Structure» de Pieter Kuiper - Propre travaux - Cette image a été créée avec POV-RAY (domaine public) via Commons Wikimedia
2. «Sphalérite-Unit-Cell-Depth-Fade-3D-balls» par Benjah-Bmm27 - Propre travaux (domaine public) via Commons Wikimedia


