Différence entre l'eau et la glace

Le différence clé entre l'eau et la glace est que le L'eau n'a pas une disposition régulière de molécules alors que la glace a une certaine structure cristalline.
Dès les premiers stades de l'évolution de la Terre, l'eau a été une partie importante de la Terre. Quant à aujourd'hui, l'eau couvre plus de 70% de la surface de la Terre. De cela, une plus grande partie de l'eau se trouve dans les océans et les mers; qui est d'environ 97%. Les rivières, les lacs et les étangs ont 0.6% d'eau et environ 2% sont là dans des calottes glaciaires et des glaciers. Une certaine quantité d'eau est présente dans la sous-terre et une quantité minute est sous la forme de gaz sous forme de vapeurs et de nuages. Parmi cela, il reste moins de 1% de l'eau pour une utilisation humaine directe. Cette eau pure devient également polluée de jour en jour, et il devrait y avoir un plan approprié pour conserver l'eau.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'eau
3. Qu'est-ce que la glace
4. Comparaison côte à côte - eau vs glace sous forme tabulaire
5. Résumé
Qu'est-ce que l'eau?
L'eau est un composé inorganique ayant la formule chimique H2O. L'eau est quelque chose dont nous ne pouvons pas vivre. Deux hydrogènes se lient de manière covalente avec un atome d'oxygène pour former une molécule d'eau. De plus, la molécule obtient une forme pliée pour minimiser la répulsion de la liaison paire seule électronique, et l'angle H-O-H est 104o. L'eau est un liquide clair, incolore, insipide et inodore. De plus, il peut être sous diverses formes telles que la brume, la rosée, la neige, la glace, la vapeur, etc. Il va à la phase gazeuse lorsque vous chauffe au-dessus de 100 oC à la pression atmosphérique normale.
L'eau est vraiment une molécule merveilleuse. C'est le composé inorganique le plus abondant de la matière vivante. Plus de 75% de notre corps compose de l'eau. Là, c'est un composant des cellules, agir comme un solvant et un réactif. Cependant, c'est un liquide à température ambiante, bien qu'il ait un faible poids moléculaire de 18 gmol-1.

Figure 01: L'eau est en phase liquide
La capacité de l'eau à former des liaisons hydrogène est une caractéristique unique qu'il a. Là, une seule molécule d'eau peut former quatre liaisons hydrogène. L'oxygène est plus électronégatif que l'hydrogène, ce qui fait les liaisons O-H dans la molécule d'eau polaire. En raison de la polarité et de la capacité de former des liaisons hydrogène, l'eau est un solvant puissant. De plus, nous l'appelons un solvant universel en raison de sa capacité à dissoudre un grand nombre de matériaux. De plus, l'eau a une tension superficielle élevée, des forces cohésives adhésives élevées. Il peut résister aux changements de température sans aller au gaz ou à la forme solide. Nous le nomdons comme ayant une capacité thermique élevée, ce qui à son tour est important pour la survie des organismes vivants.
Qu'est-ce que la glace?
La glace est la forme solide de l'eau. Quand nous appelons l'eau en dessous de 0oC Il commence à congeler de la glace en forme. La glace est transparente ou légèrement opaque. Cependant, parfois il a une couleur en fonction des impuretés qu'il contient. De plus, ce composé a une structure cristalline ordinaire ordonnée.

Figure 02: La glace flotte sur l'eau
Les liaisons hydrogène sont importantes pour rendre cette structure solide ordonnée dans la glace. Les liaisons hydrogène gardent le H2O molécules avec une certaine distance les unes des autres, formant une structure cristalline. Au cours de ce processus, le volume de la même masse de h2O se développe (ce qui signifie que la masse d'eau obtient comparativement un volume élevé lors du gel pour former de la glace). Étant donné que le volume d'eau se dilate lorsqu'il gèle, la densité de glace est inférieure à celle de l'eau. Par conséquent, il peut flotter sur l'eau. Cela empêche l'eau dans le fond des plans d'eau de geler à la période hivernale, protégez ainsi la vie aquatique.
Quelle est la différence entre l'eau et la glace?
La glace est la forme solide de l'eau, et elle a une certaine structure cristalline, mais l'eau n'a pas un tel arrangement régulier de molécules. Donc, c'est la principale différence entre l'eau et la glace. Ici, cette différence se produit en raison de la présence de liaisons hydrogène entre les molécules d'eau. Pendant le processus de congélation, les liaisons hydrogène tiennent le H2O molécules à une certaine distance les uns des autres, donnant une structure cristalline à la glace. De plus, ce processus augmente le volume. Par conséquent, comme une autre différence importante entre l'eau et la glace, nous pouvons dire que la glace a une faible densité par rapport à l'eau. Par conséquent, il peut flotter sur l'eau.
De plus, nous pouvons également identifier une différence entre l'eau et la glace en fonction de leur volume et de leur densité. C'est-à-dire; Pour la même masse, le volume d'eau est relativement inférieur à la glace. Parce que la densité de l'eau est plus élevée que celle de la glace. L'infographie ci-dessous sur la différence entre l'eau et la glace montre plus de différences entre les deux.
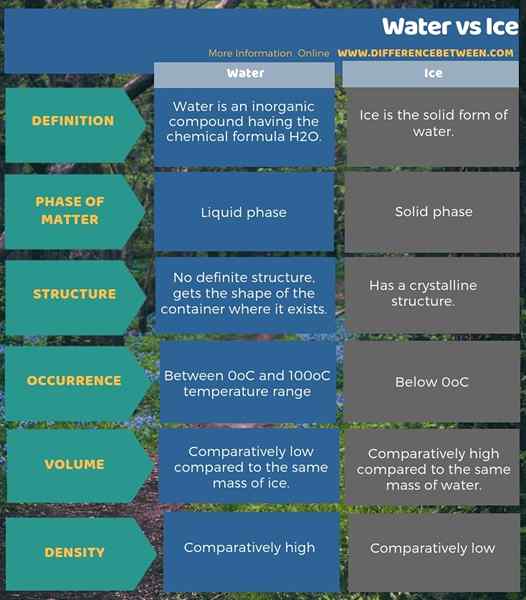
Résumé - eau vs glace
La glace est la forme solide de l'eau. Cependant, en raison de la présence de liaisons hydrogène entre les molécules d'eau, la glace se forme avec une disposition régulière de H2O Molécules lorsque nous refroidissons en dessous de 0oC. Par conséquent, la principale différence entre l'eau et la glace est que l'eau n'a pas de disposition régulière de molécules alors que la glace a une certaine structure cristalline.
Référence:
1. «Ice, eau et chimie simple.»Quatr.Guides d'étude américains, nom de l'éditeur Quatr.US Study Guides Publisher Logo, 17 avril. 2018. Disponible ici
2. Zumdahl, Steven S. "Eau.»Encyclopædia Britannica, Encyclopædia Britannica, Inc., 4 octobre. 2018. Disponible ici
Image gracieuseté:
1."Impact de la goutte d'eau sur une surface à eau - (2)” par Davide Restivo d'Aarau, Suisse - Drops # 3, (CC BY-SA 2.0) via Commons Wikimedia
2.«Water and Ice» de Victor Blacus - Propre travaux, (CC By-SA 4.0) via Commons Wikimedia


