Différence entre la valence et les électrons centraux
Le différence clé entre la valence et les électrons noyau est que Les électrons de valence participent aux formations de liaisons chimiques tandis que les électrons de base ne.
Les atomes sont les éléments constitutifs de toutes les substances existantes. Ils sont si minuscules que nous ne pouvons même pas les observer avec notre œil nu. Généralement, les atomes sont dans la gamme angstrom. L'atome est composé d'un noyau, qui a des protons et des neutrons. Il y a des électrons qui tournent autour du noyau en orbitales. La plupart de l'espace dans un atome est vide. Les forces attractives entre le noyau chargé positivement (charge positive due aux protons) et les électrons chargés négativement maintiennent la forme de l'atome. Les électrons résident en orbitales sous forme de paires dans les atomes, et ils ont des tours opposés. De plus, il existe deux types d'électrons en tant qu'électrons de valence et électrons de base.
CONTENU
1. Aperçu et différence clé
2. Que sont les électrons de valence
3. Que sont les électrons de base
4. Comparaison côte à côte - valence vs électrons noyau sous forme tabulaire
5. Résumé
Que sont les électrons de valence?
Les électrons de valence sont les électrons d'un atome qui participent à la formation de liaisons chimiques. Lorsque les liaisons chimiques se forment, un atome peut soit gagner des électrons, donner des électrons ou partager des électrons. La possibilité de donner, de gagner ou de partager ces électrons dépend du nombre d'électrons de valence dont ils ont. Par exemple, quand un H2 la molécule est formée, un atome d'hydrogène donne un électron à la liaison covalente. Ainsi, deux atomes partagent deux électrons. Par conséquent, un atome d'hydrogène a un électron de valence. Dans la formation de chlorure de sodium, un atome de sodium donne un électron, tandis qu'un atome de chlore prend un électron. Cela arrive pour remplir un octet dans leurs orbitales de valence. Là, le sodium n'a qu'un seul électron de valence, et le chlore en a sept. Par conséquent, en regardant les électrons de valence, nous pouvons déterminer la réactivité chimique des atomes.
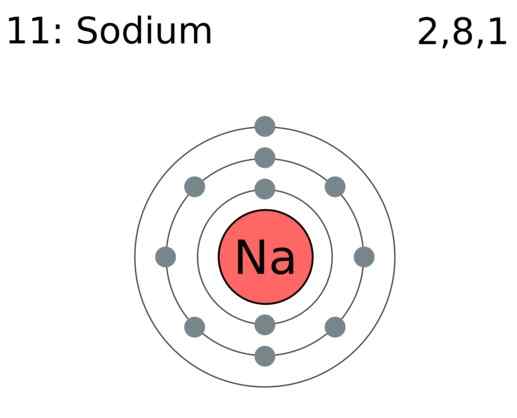
Figure 01: L'atome de sodium a un électron de valence
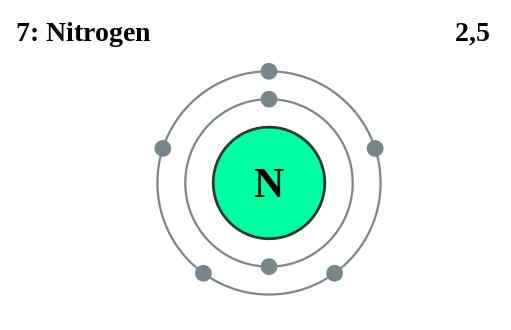
Les principaux éléments du groupe (groupe I, II, III, etc…) ont des électrons de valence dans les coquilles les plus externes. Le nombre d'électrons de valence équivaut à leur numéro de groupe. Les atomes inertes ont terminé les coquilles avec le nombre maximum d'électrons de valence. Pour les métaux de transition, certains électrons intérieurs agissent également comme des électrons de valence. Le nombre d'électrons de valence peut être déterminé en regardant la configuration d'électrons de l'atome. Par exemple, l'azote a la configuration électronique de 12 2s2 2p3. Les électrons dans le 2nd la coquille (qui est le plus haut nombre quantique principal dans ce cas) sont prises sous forme d'électrons de valence. Par conséquent, l'azote a cinq électrons de valence. En plus de participer à la liaison, les électrons de valence sont la raison de la conductivité thermique et électrique des éléments.
Que sont les électrons de base?
Les électrons noyau sont les électrons autres que les électrons de valence de l'atome. Puisque ces électrons résident aux emplacements intérieurs de l'atome, les électrons de base ne participent pas à la formation de liaisons. Ils résident dans des obus intérieurs d'un atome. Par exemple, dans un atome d'azote (12 2s2 2p3), cinq électrons sur les sept sont des électrons de valence, tandis que deux électrons 1 sont des électrons de base.

Figure 02: L'azote a deux électrons de base
De plus, l'énergie requise pour éliminer un électron central d'un atome est extrêmement plus élevée que l'énergie requise pour les électrons de valence.
Quelle est la différence entre la valence et les électrons noyau?
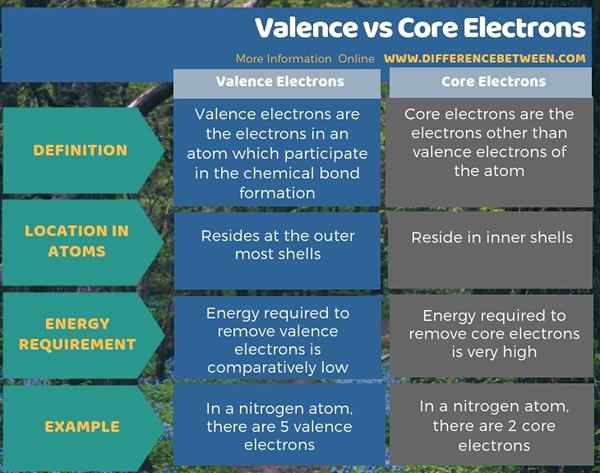
Les électrons de valence et les électrons noyau se déplacent autour du noyau d'un atome. Les électrons de valence résident sur les coquilles d'électrons les plus externes tandis que les électrons noyau résident aux coquilles intérieures. Par exemple, un atome d'azote possède 5 électrons de valence et 2 électrons de base selon la configuration des électrons; 12 2s2 2p3. Aboveall, la principale différence entre la valence et les électrons centrales est que les électrons de valence participent à la formation de liaisons chimiques, mais les électrons noyau ne sont pas.
De plus, une autre différence significative entre les électrons de valence et le noyau est que l'énergie requise pour éliminer les électrons du noyau est très élevée par rapport à l'énergie nécessaire pour éliminer les électrons de valence.
Résumé - Valence vs Core Electrons
Il existe deux types d'électrons dans un atome sous forme d'électrons de valence et d'électrons de base. Les électrons de valence résident sur les coquilles les plus externes tandis que les électrons de base sont dans les coquilles intérieures. La principale différence entre la valence et les électrons centraux est que les électrons de valence participent à la formation de liaisons chimiques tandis que les électrons noyau ne.
Référence:
1. "1.3: Electrons de valence et valences ouvertes.”Chemistry LibreTexts, LibreTexts, 23 avril. 2019, disponible ici.
2. "1.9b: valence et core électrons.”Chemistry LibreTexts, LibreTexts, 2 mai 2019, disponible ici.
Image gracieuseté:
1. «Electron Shell 011 Sodium» par Greg Robson - Application: Inkscape (CC BY-SA 2.0 UK) via Commons Wikimedia
2. «Electron Shell 007 azote» par Pumbaa (travail original de Greg Robson) - Fichier: Shell Electron 007 azote.png, (cc by-sa 2.0 UK) via Commons Wikimedia


