Différence entre l'hexafluorure de soufre et le tétrafluorure de disulfure
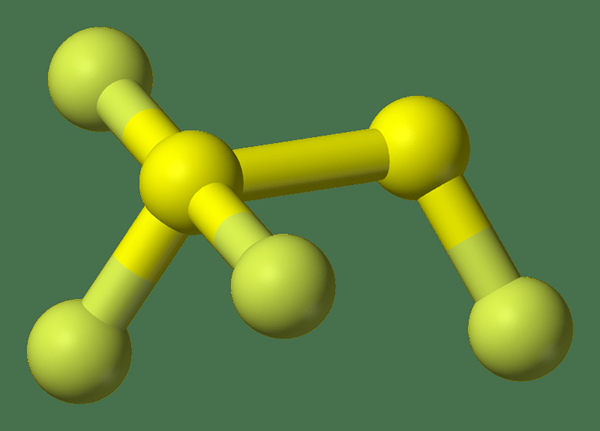
Le différence clé entre l'hexafluorure de soufre et le tétrafluorure de disulfure est que l'hexafluorure de soufre a des liaisons chimiques avec des longueurs de liaison égales, mais le tétrafluorure disulfure a des liaisons chimiques avec différentes longueurs de liaison.
L'hexafluorure de soufre et le tétrafluorure de disulfure sont des composés inorganiques. Les deux contiennent des atomes de soufre et de fluor dans différentes connectives et arrangements spatiaux. Cependant, non seulement leur structure chimique, mais l'état physique et d'autres propriétés de ces deux composés sont également différents les uns des autres. Par exemple, l'hexafluorure de soufre est un composé gazeux à température ambiante, mais le tétrafluorure disulfure est un liquide.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'hexafluorure de soufre
3. Qu'est-ce que le tétrafluorure de disulfure
4. Comparaison côte à côte - hexafluorure de soufre vs disulfure tétrafluorure sous forme tabulaire
5. Résumé
Qu'est-ce que l'hexafluorure de soufre?
L'hexafluorure de soufre est un composé inorganique ayant la formule chimique SF6. C'est un composé gazeux incolore et sans odor qui n'est pas inflammable et non toxique. Il est classé comme un gaz à effet de serre. C'est aussi un isolant électrique important. C'est un gaz plus dense que l'air.
La géométrie de ce composé est octaédrique. Les longueurs de liaison de toutes les liaisons S-F dans cette molécule sont égales. L'hexafluorure de soufre a un atome de soufre central attaché à six atomes de fluor. De plus, cette molécule est considérée comme une molécule hypervalente. Cela signifie; Cette molécule a un élément de groupe principal qui a plus de huit électrons de valence. Dans cette molécule, l'atome de soufre a douze électrons.
En raison de la connectivité des atomes et de leur arrangement spatial, la molécule hexafluorure de soufre est non polaire et est insoluble dans l'eau. Mais, il est soluble dans les solvants organiques non polaires. Nous pouvons produire ce composé en utilisant le soufre élémentaire pur et le fluor. Ici, nous devons exposer S8 solide au f2 gaz.
Il existe de nombreuses applications d'hexafluorure de soufre:
- Utilisé comme isolant électrique l'industrie électrique
- En médecine pour fournir une tamponnade dans les détachements rétiniens
- Comme agent de contraste dans l'imagerie échographique,
- En tant que gaz traceur dans le modèle de dispersion d'air de calibrage de la route, etc.
Qu'est-ce que le tétrafluorure de disulfure?
Le tétrafluorure de disulfure est un composé inorganique ayant la formule chimique S2F4. Plus précisément, nous pouvons écrire la formule structurelle de ce composé en tant que FSSF3 car il a trois atomes de fluor attachés à un atome de soufre et l'autre atome de soufre contient l'atome de fluor restant. Les longueurs de liaison de cette molécule sont différentes, ce qui est une propriété rare des molécules inorganiques.
La masse molaire de ce composé est de 140 g / mol. Il existe à l'état liquide à température ambiante. De plus, le tétrafluorure disulfure subit facilement une hydrolyse avec de l'eau. Il réagit également spontanément avec l'oxygène pour former du fluorure de thionyle. Nous pouvons préparer le tétrafluorure de disulfure en laboratoire à l'aide de chlorure de soufre qui est passé sur du fluorure de potassium à basse pression et à basse température. Cette réaction, cependant, donne plusieurs sous-produits, notamment différents chlorures et fluorures de soufre. Nous pouvons séparer le composé souhaité via une distillation à basse température.
Quelle est la différence entre l'hexafluorure de soufre et le tétrafluorure de disulfure?
L'hexafluorure de soufre et le tétrafluorure de disulfure sont des composés inorganiques contenant des atomes de soufre et de fluor. La principale différence entre l'hexafluorure de soufre et le tétrafluorure de disulfure est que l'hexafluorure de soufre a des liaisons chimiques avec une longueur de liaison égale, mais le tétrafluorure disulfure a des liaisons chimiques avec différentes longueurs de liaison de liaison. De plus, l'hexafluorure de soufre est un composé gazeux à température ambiante, mais le tétrafluorure disulfure est un liquide. Il s'agit donc d'une autre différence significative entre l'hexafluorure de soufre et le tétrafluorure de disulfure.
De plus, la masse molaire d'hexafluorure de soufre est de 146 g / mol, tandis que la masse molaire du tétrafluorure de disulfure est de 140 g / mol. En outre, nous pouvons produire de l'hexafluorure de soufre en utilisant le soufre et le fluor élémentaires purs tandis que la préparation du tétrafluorure de disulfure nécessite de passer du chlorure de soufre sur du fluorure de potassium à basse pression et basse température et séparation en utilisant une distillation à basse température à faible température et à une distillation à basse température à faible température et à une distillation à basse température à basse température et à une distillation à basse température à faible température et à une distillation à basse température à faible température et à une distillation à basse température à basse température et à une distillation à basse température à faible température.

Résumé - Hexafluorure de soufre vs disulfure tétrafluorure
L'hexafluorure de soufre et le tétrafluorure de disulfure sont des composés inorganiques contenant des atomes de soufre et de fluor. La principale différence entre l'hexafluorure de soufre et le tétrafluorure de disulfure est que l'hexafluorure de soufre a des liaisons chimiques avec des longueurs de liaison égales, tandis que le tétrafluorure de disulfure a des liaisons chimiques avec différentes longueurs de liaison.
Référence:
1. «Difluorodisulfanedifluorure." Wikipédia, Fondation Wikimedia, 26 octobre. 2019, disponible ici.
Image gracieuseté:
1. «Sulfur-Hexafluorure-3D-VDW» (Domaine public) via Commons Wikimedia
2. «Disulfur-tétrafluorride-3d-balls» par Benjah-Bmm27 - propre travail (domaine public) via Commons Wikimedia


