Différence entre le soufre, le sulfate et le sulfite

Le différence clé entre le soufre, le sulfate et le sulfite Le soufre est un élément tandis que le sulfate et le sulfite sont des anions oxy-anions de soufre.
Les produits chimiques ont des noms très uniques. Le sulfate (sulfate), le sulfite (sulfite) et le soufre (soufre) sont trois produits chimiques avec des propriétés chimiques et physiques très différentes. Un chimiste ou quiconque connaît les produits chimiques peut n'avoir aucun problème à distinguer les différences entre ces 3 produits chimiques, mais pour quelqu'un qui n'est pas familier, ces noms semblent quelque peu les mêmes. Découvrons la différence entre le soufre, le sulfate et le sulfite.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le soufre
3. Qu'est-ce que le sulfate
4. Qu'est-ce que le sulfite
5. Comparaison côte à côte - soufre, sulfate vs sulfite sous forme tabulaire
6. Résumé
Qu'est-ce que le soufre?
Le soufre est un élément non métallique. Le symbole chimique de cet élément est S. De plus, le nombre atomique de cet élément est 16. De plus, le soufre est présent dans de nombreux composés et sous diverses formes. Par conséquent, nous l'appelons un élément allotrope. Sous la forme pure, le soufre peut avoir de nombreuses formes physiques. Le plus courant est le solide de couleur jaune cristallin qui est très cassant.

Figure 01: composé de soufre
En outre, le soufre est extrêmement réactif et a de nombreuses applications. Il est utile dans la production de poudre à canon, d'insecticides et de médicaments sur ordonnance, etc.
Qu'est-ce que le sulfate?
Le sulfate est un oxy-anion du soufre (un oxy-anion est l'oxygène contenant un ion négatif). Même si vous n'êtes pas familier avec cet ion, vous devez connaître l'acide sulfurique. L'acide sulfurique se compose de deux h+ ions et un ion sulfate. La formule empirique de cet ion est DONC42- . C'est un anion polyatomique. Par conséquent, dans cet ion, l'atome de soufre est l'atome central et quatre atomes d'oxygène sont liés de manière covalente à cet atome central.
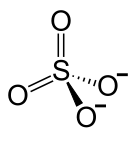
Figure 02: anion sulfate
De plus, les deux atomes d'oxygène se lient via les doubles liaisons et les deux autres sont liés simples. Par conséquent, les atomes d'oxygène liés unique contiennent à l'origine un atome d'hydrogène dans chacun d'eux. Lorsque cet ion se forme, il libère h+ et porter des charges négatives. En conséquence, la géométrie de l'ion est tétraédrique où les atomes d'oxygène se trouvent dans les quatre coins du tétraèdre.
Qu'est-ce que le sulfite?
Le sulfite est un autre oxy-anion de soufre. La formule empirique de cet ion est DONC32-. Il contient également deux charges négatives similaires à l'ion sulfate. Par conséquent, la différence entre le sulfate et le sulfite réside dans le nombre d'atomes présents dans l'ion. Ici, cet ion a trois atomes d'oxygène doublement liés à l'atome de soufre central. Quand le H+ des ions sont présents, le sulfite devient de l'acide sulfureux.
De plus, la géométrie de cet anion est pyramidale trigonale. Ainsi, les atomes d'oxygène sont sur les trois bords, et une seule paire d'électrons est sur le dessus.
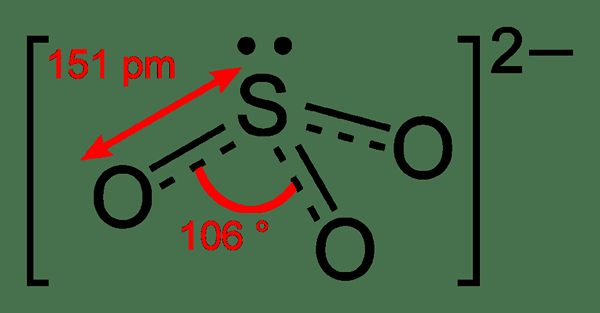
Figure 03: Anion de sulfite
En regardant ses propriétés, l'acide sulfureux est relativement plus faible que l'acide sulfurique.
Quelle est la différence entre le soufre, le sulfate et le sulfite?
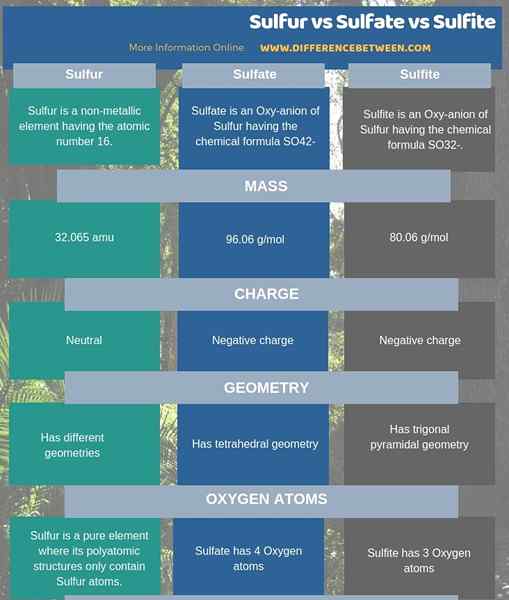
Le soufre est un élément non métallique ayant le numéro atomique 16. Tandis que le sulfate est un oxy-anion du soufre ayant la formule chimique donc42-. D'un autre côté, le sulfite est également un oxy-anion du soufre ayant la formule chimique donc32-. Par conséquent, la principale différence entre le soufre, le sulfate et le sulfite est que le soufre est un élément tandis que le sulfate et le sulfite sont oxy-anions de soufre. En conséquence, une autre différence entre le soufre, le sulfate et le sulfite est que la masse de soufre est 32.065 AMU tandis que la masse de sulfate est 96.06 g / mol. D'un autre côté, la masse de sulfite est de 80.06 g / mol.
L'infographie ci-dessous sur la différence entre le soufre, le sulfate et le sulfite montre plus de différences qui existent entre ces trois produits chimiques.
Résumé - soufre, sulfate vs sulfite
Le soufre est un élément non métallique qui implique la formation de différents composés. Au contraire, le sulfate et le sulfite sont des anions oxy-anions formées à partir de la combinaison de soufre et d'oxygène. Par conséquent, la principale différence entre le soufre, le sulfate et le sulfite est que le soufre est un élément tandis que le sulfate et le sulfite sont des anions oxy-anions de soufre.
Référence:
1. Pappas, Stéphanie. «Des faits sur le soufre.”LiveScience, Purn, 28 septembre. 2017. Disponible ici
2. «Ion sulfate.»Information du Centre national pour la biotechnologie. Base de données de composés PubChem, u.S. Bibliothèque nationale de médecine. Disponible ici
3. «Sulfite.»Wikipedia, Wikimedia Foundation, 24 avril. 2018. Disponible ici
Image gracieuseté:
1.'Sulfur-Sample'By Ben Mills - Propre travaux, (domaine public) via Commons Wikimedia
2.'Sulfate'By Leyo - Propre travaux, (domaine public) via Commons Wikimedia
3.«Sulfite-ion-2d-dimensions» (domaine public) via Commons Wikimedia