Différence entre le ligand fort et le ligand faible
Différence clé - ligand fort contre Ligand faible
Un ligand est un atome, un ion ou une molécule qui fait don ou partage deux de ses électrons par une liaison covalente coordonnée avec un atome central ou un ion. Le concept de ligands est discuté sous la chimie de la coordination. Les ligands sont des espèces chimiques impliquées dans la formation de complexes avec des ions métalliques. Par conséquent, ils sont également connus comme des agents complexés. Les ligands peuvent être monodentés, bidentés, tridentate, etc. basé sur la denticité du ligand. La denticité est le nombre de groupes de donateurs présents dans un ligand. Le monodenté signifie que le ligand n'a qu'un seul groupe de donateurs. Bidenté signifie qu'il a deux groupes de donneurs pour une molécule de ligand. Il existe deux principaux types de ligands classés en fonction de la théorie du champ cristallin; ligands forts (ou ligands de champ puissants) et ligands faibles (ou ligands de champ faibles). Le différence clé entre des ligands forts et des ligands faibles La division des orbitales après une liaison à un ligand de champ fort provoque une différence plus élevée entre les orbitales d'énergie plus élevées et plus faibles tandis que la division des orbitales après avoir lié à un ligand de champ faible provoque une différence plus faible entre les orbitales d'énergie plus élevées et plus basses.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la théorie du champ cristallin
3. Qu'est-ce que le ligand fort
4. Qu'est-ce que le ligand faible
5. Comparaison côte à côte - ligand fort vs ligand faible sous forme tabulaire
6. Résumé
Qu'est-ce que la théorie du champ cristallin?
La théorie du champ des cristaux peut être décrite comme un modèle conçu pour expliquer la rupture des dégénérescences (coquilles électroniques d'énergie égale) des orbitales électroniques (généralement d ou f orbitales) en raison du champ électrique statique produit par un anion ou des anions environnants (ou ligands). Cette théorie est souvent utilisée pour démontrer le comportement des complexes d'ions métalliques de transition. Cette théorie peut expliquer les propriétés magnétiques, les couleurs des complexes de coordination, les enthalpies d'hydratation, etc.
Théorie:
L'interaction entre l'ion métallique et les ligands est le résultat de l'attraction entre l'ion métallique avec une charge positive et la charge négative des électrons non appariés du ligand. Cette théorie est principalement basée sur les changements survenant dans cinq orbitales d'électrons dégénérées (un atome métallique a cinq orbitales D). Lorsqu'un ligand s'approche de l'ion métal. Cela provoque une perte de dégénérescence. Et aussi, les électrons dans les orbitales d repoussent les électrons du ligand (car les deux sont chargés négatifs). Par conséquent, les orbitales D plus proches du ligand ont une énergie élevée que celle des autres orbitales D. Cela entraîne le fractionnement des orbitales d en orbitales d à haute énergie et aux orbitales d basse énergie, en fonction de l'énergie.
Certains facteurs affectant ce fractionnement sont; Nature de l'ion métallique, l'état d'oxydation de l'ion métallique, la disposition des ligands autour de l'ion métallique central et la nature des ligands. Après le fractionnement de ces orbitales d basée sur l'énergie, la différence entre les orbitales D à faible et basse énergie est connue sous le nom de paramètre de division du champ de cristal (∆oct pour les complexes octaédriques).

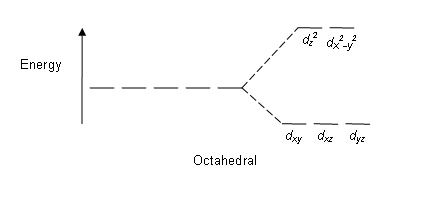
Figure 01: Modèle de division dans les complexes octaédriques
Modèle de division: Puisqu'il y a cinq orbitales d, le fractionnement se produit dans un rapport de 2: 3. Dans les complexes octaédriques, deux orbitales sont dans un niveau d'énergie élevé (collectivement connu sous le nom de 'par exemple'), et trois orbitales sont dans le niveau d'énergie inférieur (collectivement appelé T2G). Dans les complexes tétraédriques, l'inverse se produit; Trois orbitales sont dans le niveau d'énergie plus élevé et deux dans le niveau d'énergie inférieur.
Qu'est-ce que le ligand fort?
Un ligand fort ou un ligand de champ fort est un ligand qui peut entraîner une division plus élevée du champ cristallin. Cela signifie que la liaison d'un ligand de champ fort provoque une différence plus élevée entre les orbitales de niveau d'énergie supérieures et inférieures. Les exemples incluent CN- (ligands cyanure), non2- (Nitro Ligand) et Co (Ligands carbonyle).
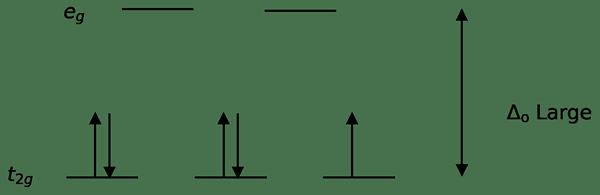
Figure 02: Diffusion à faible spin
Dans la formation de complexes avec ces ligands, au début, les orbitales d'énergie inférieure (T2G) sont complètement remplies d'électrons avant de se remplir à toute autre orbitale de niveau d'énergie élevé (par exemple). Les complexes formés de cette manière sont appelés «complexes à faible spin».
Qu'est-ce que le ligand faible?
Un ligand faible ou un ligand de champ faible est un ligand qui peut entraîner une division de champ cristallin plus faible. Cela signifie que la liaison d'un ligand de champ faible provoque une différence plus faible entre les orbitales d'énergie supérieures et inférieures.
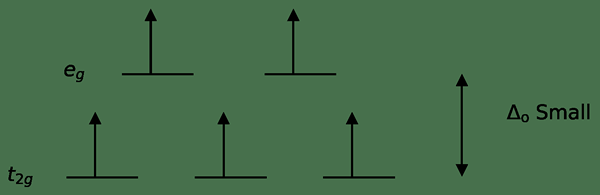
Figure 3: Diffusion de rotation élevée
Dans ce cas, comme la faible différence entre les deux niveaux orbitaux provoque des répulsions entre les électrons dans ces niveaux d'énergie, les orbitales énergétiques plus élevées peuvent être facilement remplies d'électrons par rapport à celles des orbitales à faible énergie. Les complexes formés avec ces ligands sont appelés «complexes de spin élevé». Des exemples de ligands de terrain faibles incluent i- (ligand iodure), br- (ligand bromure), etc.
Quelle est la différence entre le ligand fort et le ligand faible?
Ligand fort vs ligand faible | |
| Un ligand fort ou un ligand de champ fort est un ligand qui peut entraîner une division plus élevée du champ cristallin. | Un ligand faible ou un ligand de champ faible est un ligand qui peut entraîner une division de champ cristallin plus faible. |
| Théorie | |
| Le fractionnement après avoir lié un ligand de champ fort provoque une différence plus élevée entre les orbitales d'énergie plus élevées et inférieures. | Le fractionnement des orbitales après avoir lié un ligand de champ faible provoque une différence plus faible entre les orbitales d'énergie supérieures et inférieures. |
| Catégorie | |
| Les complexes formés avec de forts ligands de champ sont appelés «complexes à faible spin». | Les complexes formés avec des ligands de champ faibles sont appelés «complexes de spin élevé». |
Résumé - Ligand fort contre Ligand faible
Les ligands forts et les ligands faibles sont des anions ou des molécules qui provoquent la séparation des orbitales D d'un ion métallique en deux niveaux d'énergie. La différence entre les ligands forts et les ligands faibles est que la division après avoir lié un ligand de champ fort provoque une différence plus élevée entre les orbitales de niveau d'énergie plus élevées et plus faibles tandis que la division des orbitales après avoir lié un ligand de champ faible provoque une différence plus faible entre le plus haut et le plus bas orbitales de niveau d'énergie.
Référence:
1.Helmenstine, Anne Marie, D. «Définition du ligand."Thoughtco, février. 11, 2017. Disponible ici
2.«Ligands.”Chemistry LibreTexts, LibreTexts, 19 janvier. 2018. Disponible ici
3.Les éditeurs d'Encyclopædia Britannica. «Ligand.»Encyclopædia Britannica, Encyclopædia Britannica, Inc., 12 août. 2010. Disponible ici
Image gracieuseté:
1.'Octaédrique Crystal-Field Splating' par utilisateur de wikipedia anglais Yana, (CC By-SA 3.0) via Commons Wikimedia
2.'CFT-Low Spin Diaging Diagram-Vector'By Offnfopt, (Domain public) via Commons Wikimedia
3.'CFT-High Spin Diagrting Diagram-Vector'By Offnfopt, Image de référence créée par Yana - Propre travaux (domaine public) via Commons Wikimedia


