Différence entre les complexes plans carrés et tétraédriques
Le différence clé entre les complexes planaires carrés et tétraédriques est que Les complexes planaires carrés ont un diagramme de champ cristallin à quatre niveaux, mais les complexes tétraédriques ont un diagramme de champ cristallin à deux niveaux.
La théorie du champ cristallin est une théorie de la chimie qui décrit la rupture des orbitales électroniques (principalement des orbitales D et F) en raison du champ électrique statique produit par la charge anionique dans l'environnement d'un atome. La théorie est très importante pour décrire les propriétés des complexes de métaux de transition. Nous pouvons également décrire les structures des complexes planaires carrés et tétraédriques.
CONTENU
1. Aperçu et différence clé
2. Quels sont les complexes planaires carrés
3. Quels sont les complexes tétraédriques
4. Comparaison côte à côte - planaire carré vs. Complexes tétraédriques sous forme tabulaire
5. Résumé
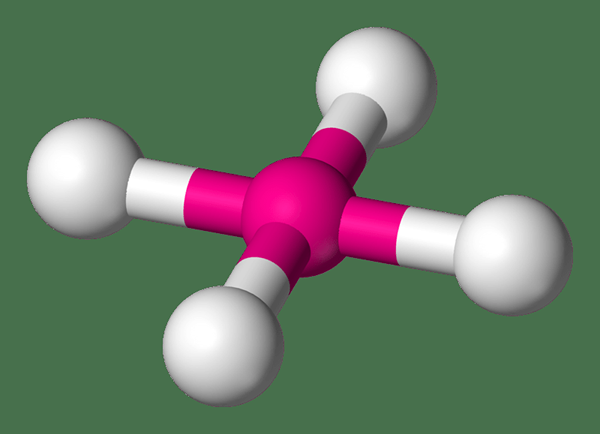
Quels sont les complexes planaires carrés
Les complexes plans carrés sont des complexes de coordination qui ont un atome métallique central entouré de quatre atomes constitutifs dans les coins du même plan carré. Les angles de liaison des liaisons dans cette structure sont de 90 °. Métaux de transition ayant la configuration électronique terminant d8 Forme de complexes de coordination ayant cette géométrie moléculaire. Par exemple, Rh (i), Ir (i), Pd (ii), etc. Le numéro de coordination d'un complexe plan carré est quatre.
Nous pouvons décrire la structure de ces complexes en utilisant la théorie du champ cristallin (CFT). Selon cette théorie, un complexe plan carré a un diagramme de champ cristallin à quatre niveaux. Et, ce fractionnement à quatre niveaux est nommé D4h. Les quatre niveaux d'énergie résultants sont nommés Dx2-y2, dxy, dz2, Et [Dxz, dyz]]. De plus, il existe une relation spécifique entre la géométrie planaire carrée et la géométrie tétraédrique. Nous pouvons convertir une géométrie tétraédrique en géométrie plane carrée en aplatissant le tétraèdre. Et, cette conversion fournit une voie pour l'isomérisation des complexes tétraédriques.
Quels sont les complexes tétraédriques?
Les complexes tétraédriques sont des complexes de coordination qui ont un atome métallique central entouré de quatre atomes constituants dans les coins d'un tétraèdre. Les angles de liaison des liaisons dans cette structure sont d'environ 109.5 °. Cependant, si les constituants sont différents les uns des autres, les angles de liaison varient. Il existe deux types de métaux de transition qui peuvent former ce type de complexe: les métaux ayant d0 configuration et ddix configuration.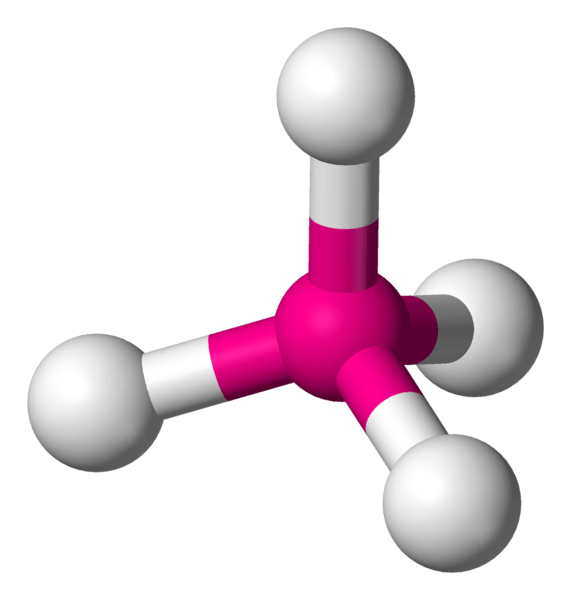
De plus, selon la théorie du champ cristallin, les complexes tétraédriques ont un diagramme de champ cristallin à deux niveaux. Les deux niveaux d'énergie de ce diagramme comprennent deux ensembles d'orbitales: Dxy, dxz, dyz en un niveau d'énergie, et dx2-y2, dz2 Dans l'autre ensemble.
Quelle est la différence entre les complexes planaires carrés et tétraédriques?
La théorie du champ cristallin est très importante pour décrire les propriétés des complexes de métaux de transition, ainsi que les structures des complexes plans carrés et tétraédriques. La principale différence entre les complexes plans carrés et tétraédriques est que les complexes planaires carrés ont un diagramme de champ cristallin à quatre niveaux, mais les complexes tétraédriques ont un diagramme de champ cristallin à deux niveaux.
De plus, les métaux de transition ayant leurs configurations électroniques se terminant par D8 La configuration a tendance à former des complexes planaires carrés, tandis que les métaux ayant d0 configuration et ddix La configuration a tendance à former des complexes tétraédriques.
L'infographie ci-dessous montre plus de comparaisons concernant la différence entre les complexes planaires carrés et tétraédriques.
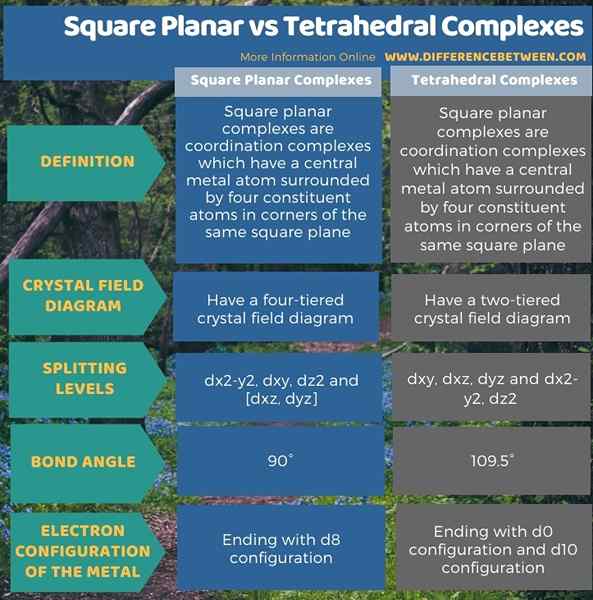
Résumé - Square Planar vs. Complexes tétraédriques
La théorie du champ cristallin est très importante pour décrire les propriétés des complexes de métaux de transition. Nous pouvons également décrire les structures des complexes planaires carrés et tétraédriques. La principale différence entre les complexes plans carrés et tétraédriques est que les complexes planaires carrés ont un diagramme de champ cristallin à quatre niveaux, tandis que les complexes tétraédriques ont un diagramme de champ cristallin à deux niveaux.
Référence:
1. Mott, Valerie. «Introduction à la chimie.”Lumen, disponible ici.
2. «Bondage dans les composés de coordination: théorie du champ cristallin.«Chimie sans limites, lumen, disponible ici.
3. «Théorie du champ cristallin.”LiBerTexts, disponible ici.
Image gracieuseté:
1. «Square-planar-3D-balls» (domaine public) via les communes Wikimedia
2. «Tetraheddral-3D-balls» (domaine public) via Commons Wikimedia


