Différence entre SiO2 et CO2

Le différence clé Entre SiO2 et CO2 est que Le SiO2 existe en phase solide alors que le CO2 existe en phase gazeuse aux conditions de température et de pression standard.
SiO2 est le dioxyde de silicium. Le CO2 est le dioxyde de carbone. Le silicium et le carbone sont tous deux des éléments du groupe 14 dans le tableau périodique des éléments. Ces deux oxydes sont les oxydes les plus courants et les plus stables qu'ils forment. Cependant, il existe de nombreuses différences entre SiO2 et CO2. La principale différence entre SiO2 et CO2 est la phase à laquelle ils existent à la température et à la pression standard.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que SiO2
3. Qu'est-ce que le CO2
4. Comparaison côte à côte - Sio2 vs CO2 sous forme tabulaire
5. Résumé
Qu'est-ce que SiO2?
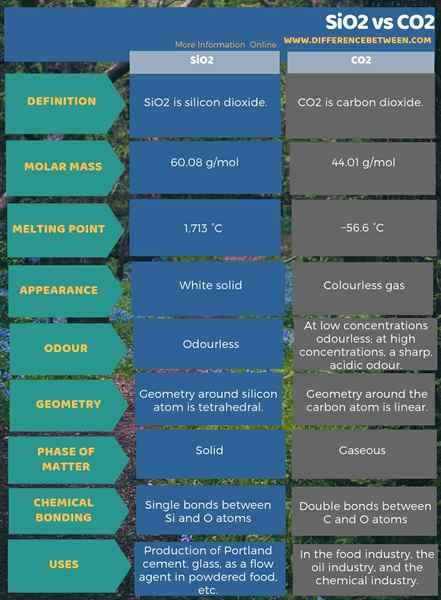
SiO2 est le dioxyde de silicium. C'est l'oxyde de silicium le plus courant et le plus stable. Ce composé existe à la phase solide aux conditions de température et de pression standard. Nous pouvons le trouver dans la nature comme quartz. Il existe comme le principal constituant du sable. La masse molaire de ce composé est de 60.08 g / mol. Il apparaît comme un solide blanc. Les points de fusion et d'ébullition sont respectivement de 1 713 ° C et 2 950 ° C.

Figure 01: Échantillon de dioxyde de silicium
Bien que l'atome de silicium ne contient que deux atomes d'oxygène liés, la géométrie autour de l'atome de silicium serait tétraédrique. C'est parce que ce composé existe comme une substance polymère ayant des unités de répétition SiO4. Il y a de nombreuses utilisations de ce composé. Il a des applications à des fins de construction, je.e. Production de Portland Cement. De plus, c'est le principal ingrédient de la production de verre. De plus, SiO2 est également utile dans les applications alimentaires et pharmaceutiques, je.e. En tant qu'agent de débit dans des aliments en poudre.
Qu'est-ce que le CO2?
Le CO2 est le dioxyde de carbone, et c'est l'oxyde de carbone le plus courant et le plus stable. Il existe dans la phase gazeuse aux conditions de température et de pression standard. Le CO2 se produit naturellement sous forme de dioxyde de carbone dans l'atmosphère (environ 0.03%). C'est un gaz incolore avec une densité plus élevée que l'air sec. La masse molaire est 44.01 g / mol. À de faibles concentrations, il est inodore, mais à haute concentration, il a une odeur acide et acide. Le point de fusion de CO2 est de -56.6 ° C.

Figure 02: Bubbles de dioxyde de carbone dans une boisson gazeuse
Cette molécule a une structure linéaire. Les deux atomes d'oxygène se lient avec l'atome de carbone via des liaisons doubles sur les côtés opposés. La molécule n'a pas de dipôle électrique car il est symétrique. De plus, ce composé est soluble dans l'eau; il forme l'acide carbonique faible. Presque tous les organismes aérobies produisent ce gaz dans leur respiration. Il a de nombreuses utilisations dans l'industrie alimentaire, l'industrie pétrolière et l'industrie chimique. Par exemple, c'est un précurseur pour de nombreux autres produits chimiques tels que le méthanol. De plus, c'est un additif alimentaire, et nous l'utilisons pour la production de boissons gazeuses gazeuses. En dehors de cela, nous pouvons utiliser le dioxyde de carbone pour éteindre les flammes.
Quelle est la différence entre SiO2 et CO2?
SiO2 est le dioxyde de silicium et le CO2 est le dioxyde de carbone. La principale différence entre SiO2 et CO2 est que le SiO2 existe dans la phase solide alors que le CO2 existe dans la phase gazeuse aux conditions de température et de pression standard. De plus, le dioxyde de silicium a une couleur blanche tandis que le dioxyde de carbone est un composé incolore.
Une différence importante entre SiO2 et CO2 est que le SiO2 a la géométrie tétraédrique autour de l'atome de silicium tandis que le CO2 a la géométrie linéaire autour de l'atome de carbone. Une autre différence entre SiO2 et CO2 est que le SiO2 a des liaisons uniques entre les atomes de Si et O tandis que le CO2 a des liaisons doubles entre les atomes C et O.
Résumé - SiO2 vs CO2
Le silicium (Si) et le carbone (C) sont tous deux des éléments du groupe 14 dans le tableau périodique. De plus, les oxydes les plus courants de ces éléments sont SiO2 et CO2. La principale différence entre SiO2 et CO2 est que le SiO2 existe dans la phase solide alors que le CO2 existe dans la phase gazeuse aux conditions de température et de pression standard.
Référence:
1. Britannica, les éditeurs de l'Encyclopaedia. "Gaz carbonique.»Encyclopædia Britannica, Encyclopædia Britannica, Inc., 3 janvier. 2018. Disponible ici
2. "Dioxyde de silicone.»Wikipedia, Wikimedia Foundation, 19 novembre. 2018. Disponible ici
Image gracieuseté:
1.«Échantillon de dioxyde de silicium» par lhchem - propre travail, (cc by-sa 3.0) via Commons Wikimedia
2.«Soda Bubbles Macro» par Spiff (Domaine public) via Commons Wikimedia


