Différence entre isotonique et hypertonique
Différence clé - Isotonique vs hypertonique
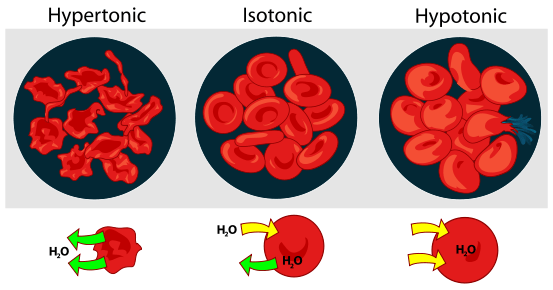
Il est important de comprendre le concept de la tonique avant d'analyser la différence entre isotonique et hypertonique. Par conséquent, décrivons d'abord le concept de la tonique et de son importance. La tonicité est la variance de la concentration en eau de deux solutions divisées par une membrane semi-perméable. Il peut également être expliqué comme la concentration relative d'eau des solutions qui décident de la direction et de la quantité de diffusion de l'eau jusqu'à ce qu'elle atteigne des concentrations égales des deux côtés de la membrane. En identifiant la tonicité des solutions, nous pouvons déterminer dans quelle direction l'eau diffusera. Ce phénomène est couramment utilisé lors de l'illustration de la réponse des cellules immergées dans une solution externe. Il y a trois classifications de la tonicicité qu'une solution peut avoir par rapport à un autre.Ils sont hypertoniques, hypotoniques et isotoniques. Le différence clé entre isotonique et hypertonique La solution hypertonique contient plus de solvant que de soluté alors que Le soluté et le solvant sont également distribués dans la solution isotonique. Cependant, la mémorisation de la définition des solutions hypertoniques et isotoniques n'est pas essentielle si nous pouvons comprendre la différence entre les solutions isotoniques et hypertoniques.
Qu'est-ce que l'hypertonique?
Hyper est un autre mot pour ci-dessus ou excessif. Les solutions hypertoniques auront une concentration plus élevée de soluté (glucose ou sel) que la cellule. Les solutés sont les éléments dissous dans un solvant, formant ainsi une solution. Dans une solution hypertonique, la concentration de solutés est plus grande en dehors de la cellule que à l'intérieur. Lorsqu'une cellule est immergée dans une solution hypertonique, il y aura un décalage osmotique et les molécules d'eau s'écouleront de la cellule afin d'équilibrer la concentration des solutés et il y aura un rétrécissement dans la taille de la cellule.
Qu'est-ce que l'isotonique?
ISO est un autre mot pour l'égalité et le tonique est pour la tonicité de la solution. Les solutions isotoniques auront une concentration similaire de soluté que la solution à laquelle elle est comparée. Dans une solution isotonique, la concentration de solutés est la même à l'intérieur et à l'extérieur de la cellule créant un équilibre dans l'environnement de l'organisation cellulaire. Lorsqu'une cellule est immergée dans une solution isotonique, il n'y aura pas de décalage osmotique et de molécules d'eau diffus à travers la membrane cellulaire dans les deux directions pour équilibrer la concentration des solutés. Ce processus ne créera pas de gonflement ou de rétrécissement de la cellule.
Quelle est la différence entre isotonique et hypertonique?
Les différences entre hypertonique et isotonique peuvent être classées en catégories suivantes.
Définition de Isotonique et hypertonique
Hypertonique: «Hyper» est connu comme ci-dessus ou excessif + «tonique» est connu comme quelque chose dans le sens d'une solution. Ainsi, l'hypertonic suggère une tonicité accrue de la solution.
Isotonique: «ISO» est connu comme le même + «tonique» est connu comme quelque chose dans le sens d'une solution. Ainsi, l'isotonique suggère une tonicité similaire de la solution.
Caractéristiques de Isotonique et hypertonique
Concentration de soluté et de solution
Hypertonique: La solution contient plus de solvant que de soluté.
Isotonique: Le soluté et le solvant dans la solution sont distribués de manière égale.
Exemples
Hypertonique: L'eau purifiée, car aucun / moins de soluté est dissous dans l'eau purifiée, et sa concentration est très faible par rapport à l'environnement cellulaire.
Isotonique: La solution saline est un plasma sanguin isotonique au sang humain
Réponse des cellules en solution hypertonique et isotonique (Voir figure 1)
Hypertonique: Lorsqu'une cellule biologique est dans un environnement hypertonique, l'eau traverse la membrane cellulaire hors de la cellule, afin d'équilibrer la concentration de solutés dans la cellule et l'environnement autour de la cellule. En conséquence, le la cellule va rétrécir Comme l'eau quitte la cellule pour réduire la concentration plus élevée de soluté dans l'environnement extérieur.
Isotonique: Lorsqu'une cellule est dans une solution isotonique, elle ne créera pas de gonflement ou de rétrécissement de la cellule.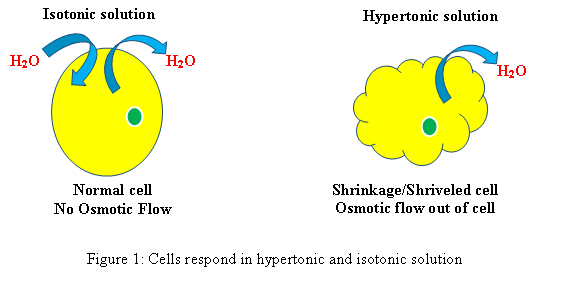
Gradient de concentration d'eau
Hypertonique: Le gradient de concentration d'eau peut être observé de l'intérieur de la cellule à la solution hypertonique
Isotonique: Le gradient de concentration d'eau n'existe pas
Gradient de concentration de soluté
Hypertonique: Le gradient de concentration de soluté est observé de la solution hypertonique à l'intérieur de la cellule
Isotonique: Le gradient de concentration de soluté n'existe pas.
Shift osmotique
Hypertonique: un changement osmotique existe.
Isotonique: Le changement osmotique n'existe pas
Mouvement de l'eau
Hypertonique: Les molécules d'eau se déplacent ou diffusent rapidement de l'intérieur de la cellule aux directions de la solution externe, et donc la cellule perdra de l'eau.
Isotonique: Les molécules d'eau se déplacent ou diffusent dans les deux directions, et le taux de diffusion de l'eau est similaire dans chaque direction. Ainsi, la cellule obtiendra ou perdra de l'eau.
Boissons pour sportifs
Isotonique: Une boisson isotonique comprend des concentrations similaires de sel, de glucides de sucre et d'électrolytes comme dans le corps humain. La boisson sportive isotonique est souvent préférée comme une solution de réhydratation orale. Il a généralement 4 à 8 g de glucides pour 100 ml.
Hypertonique: La boisson hypertonique comprend des concentrations plus élevées de sel, de glucides de sucre et d'électrolytes comme dans le corps humain. Il a généralement environ 8 g de glucides pour 100 ml. Une solution hypertonique est également utilisée dans l'osmothérapie afin de gérer l'hémorragie cérébrale. Les boissons pour sportifs hypertoniques sont idéales pour ceux qui ont besoin de très haut niveau d'énergie.
En conclusion, il existe trois formes de solutions qui sont basées sur la concentration de soluté et elles sont isotoniques, hypotoniques et hypertoniques. La concentration de solutés est la même à l'intérieur et à l'extérieur de la cellule dans une solution isotonique. La concentration de solutés est plus grande à l'intérieur de la cellule que l'environnement extérieur dans une solution hypotonique tandis que la solution hypertonique est celle où la concentration de solutés est plus grande.
Références Mansoor, M. UN., Beverly, J., et Sandmann. (2002). Pharmacie physique appliquée. McGraw-Hill Professional. pp. 54-57. Voet, D., Judith, G. V. et Charlotte, W. P. (2001). Fondamentaux de la biochimie (Rev.élégant.). New York: Wiley. p.30. Image gracieuseté: «Pression osmotique sur le diagramme des cellules sanguines» par LadyOfhats - l'a fait moi-même basé sur [1], [2], [3] et [4]… (domaine public) via Wikimedia Commons


