Différence entre le droit des taux et la loi de l'action de masse
Différence clé - Loi de taux vs loi de l'action en masse
Le différence clé entre le droit des taux et la loi de l'action en masse est que La loi sur le taux indique la relation entre la vitesse d'une réaction chimique et les concentrations de réactifs tandis que la loi de l'action de masse indique que la vitesse d'une réaction chimique est proportionnelle aux masses des substances réagissantes.
La loi sur les taux est une loi en chimie qui est utilisée pour expliquer le comportement d'un mélange réactionnel. La loi de vitesse indique que la vitesse d'une réaction est directement proportionnelle à la vitesse de réaction. La constante de proportionnalité est connue sous le nom de constante de vitesse. La loi de l'action de masse indique que la vitesse de réaction d'une réaction chimique est directement proportionnelle au produit de masses de réactifs qui sont élevés à une puissance (il est souvent égal à leur coefficient stoechiométrique dans l'équation chimique) qui est déterminé expérimentalement.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la loi sur les taux
3. Qu'est-ce que la loi de l'action de masse
4. Comparaison côte à côte - Loi de taux vs loi de l'action de masse sous forme tabulaire
5. Résumé
Qu'est-ce que la loi sur les taux?
La loi sur la vitesse indique la relation entre la vitesse d'une réaction chimique et les concentrations de réactifs. Selon la loi sur la vitesse, la vitesse d'une réaction est directement proportionnelle aux concentrations de réactifs qui sont élevés à un pouvoir (il est souvent égal à la relation stoechiométrique dans l'équation chimique) qui est déterminée expérimentalement.
La loi sur les taux peut être trouvée dans deux types comme suit:
- Loi sur les taux différentiels
La loi sur la vitesse différentielle donne le taux de réaction en fonction du changement de concentration des réactifs pendant une période particulière.
- Loi sur les taux intégrés
La loi de vitesse intégrée donne le taux d'une réaction en fonction de la concentration initiale d'un réactif à une période spécifique.
Considérons un exemple pour comprendre cela.
AA + BB → CC + DD
Taux = k [a]un[B]b
L'équation ci-dessus donne l'expression mathématique de la loi sur les taux. Là, «k» est une constante de proportionnalité. Il est connu comme la constante de taux. Les exposants «A» et «B» sont les ordres de réaction par rapport aux réactifs A et B respectivement. L'ordre global (p) de la réaction est donné comme la somme de tous les ordres de l'équation de la loi.
p = a + b

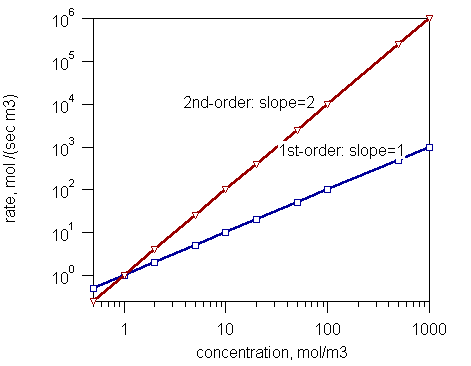
Figure 1: La vitesse de réaction et la concentration de réactions de premier ordre et des réactions de second ordre.
Sur la base de l'ordre global d'une réaction, les réactions sont en trois types comme:
- Réactions d'ordre zéro - La vitesse de réaction est indépendante de la concentration de réactifs
- Réactions de premier ordre - La vitesse de réaction est proportionnelle à la concentration d'un réactif.
- Réactions de second ordre - Le taux de réaction est proportionnel soit au produit de concentrations de deux réactifs, soit au carré de la concentration d'un réactif.
Qu'est-ce que la loi de l'action de masse?
La loi de l'action de masse indique que la vitesse d'une réaction chimique est proportionnelle aux masses des substances réagissantes. Il est également connu comme le droit de l'action de masse. Cette loi est utile pour obtenir l'équation d'équilibre précise d'une réaction chimique particulière. La loi est également donnée par des activités ou des concentrations de réactifs. Selon la loi de l'action de masse, le rapport entre les concentrations de produits et de réactifs est une constante dans un mélange réactionnel qui se trouve dans un état d'équilibre.
La loi de l'action de masse est un concept universel, ce qui signifie qu'il s'applique à tout système en toute circonstance. Cette loi peut être donnée dans une expression mathématique comme ci-dessous.
Pour la réaction,
aa + bb ↔ cc + dd
Le rapport entre les produits et les réactifs à l'équilibre;
Keq = [c]c[D]d / [UN]un[B]b
À une température donnée, le rapport ci-dessus est une constante pour l'équilibre entre les réactifs (A et B) et les produits (C et D). Ici, Keq est connu comme la constante d'équilibre.
Quelle est la différence entre le droit des taux et la loi de l'action de masse?
Loi de taux vs loi de l'action de masse | |
| La loi sur la vitesse indique que la vitesse d'une réaction est directement proportionnelle aux concentrations de réactifs qui sont élevés à une puissance déterminée expérimentalement. | La loi de l'action de masse indique que la vitesse d'une réaction chimique est proportionnelle aux masses des substances réagissantes. |
| Composants de l'équation | |
| L'équation de la loi de vitesse a une constante de vitesse, des concentrations de réactifs et l'ordre de réaction. | La loi de l'action de masse a une équation composée de concentrations de produits et de réactifs soulevés au pouvoir de leur coefficient stoichiométrique. |
| Produit | |
| L'équation de la loi taux ne contient pas de concentrations de produits. | La loi de l'équation d'action de masse contient les concentrations de produits. |
| Composant de proportionnalité | |
| La constante de proportionnalité de l'équation de la loi sur le taux est connue comme la constante de taux «K». | Il n'y a pas de proportionnalité constante dans la loi de l'équation d'action de masse. |
Résumé - Loi de taux vs loi de l'action en masse
Les lois sur les taux et la loi de l'action en masse sont utilisées pour expliquer le comportement d'un mélange réactionnel. La principale différence entre la loi sur les taux et la loi de l'action en masse est que la loi sur la vitesse indique la relation entre le taux d'une réaction chimique et les concentrations de réactifs tandis que la loi de l'action de masse indique que le taux de réaction chimique est proportionnel aux concentrations de concentrations de les substances réagies.
Référence:
1. «La loi sur les taux.”Chemistry LibreTexts, 21 juillet 2016, disponible ici.
2. «12.3 lois sur les taux.»Chimie, disponible ici.
3. Laidler, Keith J. «Loi de l'action de masse.»Encyclopædia Britannica, Encyclopædia Britannica, Inc., 26 octobre. 2016, disponible ici.
Image gracieuseté:
1. «Rateloglogplot» de Fabiuccio ~ EnwikiBooks à l'anglais WikiBooks - transféré de EN.WikiBooks aux communes., (Domaine public) via Commons Wikimedia


