Différence entre l'expression des taux et la loi sur les taux

Le différence clé entre l'expression des taux et la loi sur les taux est que L'expression du taux donne le taux d'apparence ou de disparition des produits ou des réactifs, tandis que la loi de taux donne la relation entre le taux et la concentration ou la pression des réactifs.
Lorsqu'un ou plusieurs réactifs sont convertis en produits, ils peuvent passer par différentes modifications et changements d'énergie. Les liaisons chimiques dans les réactifs se cassent et de nouvelles liaisons sont formées pour générer des produits totalement différents des réactifs. Cette modification chimique est connue sous le nom de réactions chimiques. L'expression du taux et la loi sur le taux sont des concepts chimiques importants que nous pouvons décrire dans les réactions chimiques.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'expression du taux
3. Qu'est-ce que la loi sur les taux
4. Comparaison côte à côte - Expression du taux par rapport à la loi sur le taux sous forme tabulaire
5. Résumé
Qu'est-ce que l'expression du taux?
L'expression de vitesse est la façon de représenter le changement de concentration de réactifs sur le temps de la réaction. Nous pouvons donner cette expression en utilisant l'un des réactifs et produits de la réaction. Lorsque vous donnez l'expression du taux par rapport aux réactifs, nous devons utiliser un signe moins car, pendant la réaction, la quantité de réactif diminue avec le temps. Lors de l'écriture de l'expression du taux à l'aide de produits, plus le signe est utilisé car la quantité de produits augmente avec le temps.
De plus, nous devons considérer les relations stoechiométriques lorsque vous donnez l'expression du taux pour égaliser toute l'expression du taux donné de quelque manière que ce soit. Par exemple, considérons la réaction chimique suivante et les expressions de vitesse que nous pouvons donner pour cela;
2x + 3y ⟶ 5Z
Les expressions de vitesse suivantes sont possibles pour la réaction ci-dessus:

Qu'est-ce que la loi sur les taux?
La loi sur les taux est l'expression mathématique du taux d'une réaction qui comprend la relation entre le taux des réactifs et le taux du produit. Nous pouvons déterminer ces données mathématiques expérimentalement, et nous pouvons également vérifier la relation. Il existe deux façons principales de rédiger une loi sur les taux; Loi sur les taux différentiels et loi intégrée.
Loi sur les taux différentiels
La loi sur la vitesse différentielle est le moyen d'exprimer la vitesse de réaction en utilisant le changement de concentration d'un ou plusieurs réactifs. Ici, nous considérons le changement de concentration du ou des réactifs sur une période de temps spécifique. Nous nommons cet intervalle de temps comme Δt. Nous pouvons nommer le changement de concentration du réactif «R» comme δ [R]. Considérons un exemple pour comprendre comment rédiger une loi sur les taux différentiels. Pour une réaction dans laquelle le réactif «A» se décompose pour donner les produits et k est la vitesse constante tandis que n est l'ordre de cette réaction, alors l'équation de ce taux est la suivante:
- A ⟶ Produits
La loi sur les taux différentiels est la suivante:
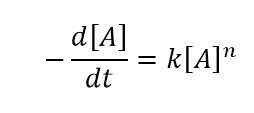
Loi sur les taux intégrés
La loi sur la vitesse intégrée est le moyen d'exprimer la vitesse de réaction en fonction du temps. Nous pouvons obtenir cette expression en utilisant la loi sur les taux différentiels via l'intégration de la loi sur les taux différentiels. Nous pouvons également obtenir cette loi intégrée à un taux ordinaire.
Par exemple, pour la réaction A ⟶ Products, la loi de taux ordinaire est la suivante:
Taux (r) = k [a]
où k est la vitesse constante et [a] est la concentration de réactif A. Si nous considérons un petit intervalle de temps, nous pouvons écrire l'équation ci-dessus comme suit:
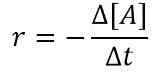
Nous utilisons le signe moins (-) ici parce que A est le réactif et avec un temps croissant, la concentration d'un. Ensuite, nous pouvons obtenir une relation comme suit en combinant les deux équations ci-dessus;
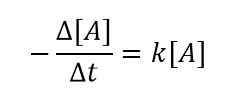
Pour un très petit changement de concentration de réactifs à un très petit intervalle de temps, nous pouvons écrire l'équation comme ci-dessous;
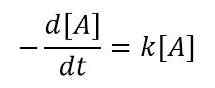
Ou
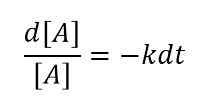
Ensuite, en intégrant cette équation, nous pouvons obtenir la relation suivante:
ln [a] = -kt + constante
Par conséquent, lorsque le temps est nul ou t = 0, Ln [a] est la concentration initiale d'un réactif (nous pouvons le donner comme [a]0) Puisque à t = 0, -kt = 0 donc ln [a]0= constant. Pour une réaction de premier ordre, la loi sur la vitesse intégrée est,
ln [a] = ln [a]0 - kt
Quelle est la différence entre l'expression du taux et la loi sur les taux?
L'expression du taux et le taux AW sont deux façons de donner des détails sur le taux de réaction. La principale différence entre l'expression des taux et la loi sur le taux est que l'expression du taux donne le taux d'apparence ou de disparition des produits ou des réactifs, tandis que la loi de taux donne la relation entre le taux et la concentration ou la pression des réactifs.
L'infographie ci-dessous résume la différence entre l'expression des taux et la loi sur les taux.
Résumé - Expression des taux vs loi sur les taux
La loi sur l'expression du taux et le taux sont deux façons de donner des détails sur le taux de réaction. La principale différence entre l'expression des taux et la loi sur le taux est que l'expression du taux donne le taux d'apparence ou de disparition des produits ou des réactifs, tandis que la loi de taux donne la relation entre le taux et la concentration ou la pression des réactifs.
Référence:
1. «Expression de vitesse et ordre de réaction." LinkedIn SlideShare, 15 septembre. 2013, disponible ici.


