Différence entre Protium et Deuterium

Le différence clé entre Protium et le deutérium est que Protium n'a pas de neutrons dans son noyau atomique, tandis que le deutérium a un neutron.
Protium et le deutérium sont des isotopes d'hydrogène. Par conséquent, ils diffèrent les uns des autres en fonction du nombre de neutrons présents dans leurs noyaux atomiques. L'hydrogène contient un proton dans le noyau atomique: donc, le nombre atomique d'hydrogène est 1. Il y a trois isotopes d'hydrogène. Les trois isotopes contiennent également un proton. Nous pouvons désigner les trois isotopes comme 1H, 2Main 3H. Les valeurs en exposant sont les masses atomiques de ces éléments.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que Protium
3. Qu'est-ce que le deutérium
4. Comparaison côte à côte - Protium vs deutérium sous forme tabulaire
5. Résumé
Qu'est-ce que Protium?
Protium est un isotope d'hydrogène qui contient un proton et un électron. Il n'a pas de neutrons dans le noyau atomique. Par conséquent, il n'y a qu'un seul proton dans le noyau. Cet isotope est nommé comme tel en raison de la présence de ce seul proton. Nous pouvons indiquer est comme 1H ou hydrogène-1, où 1 est la masse atomique du protéger.

Le protium est l'isotope de l'hydrogène le plus courant et le plus abondant. L'abondance est d'environ 99%. Ceci est considéré comme un isotope stable parce que le proton de cet atome n'a jamais été observé pour subir une décroissance. Cependant, selon les théories, il subit une décomposition avec une très grande demi-vie, de sorte qu'elle n'est pas observable.
Qu'est-ce que le deutérium?
Le deutérium est un isotope d'hydrogène ayant un proton, un neutron et un électron. Contrairement à Protium, cet isotope a un proton et un neutron ensemble dans le noyau atomique. Par conséquent, la masse atomique de cet isotope est 2. Ensuite, nous pouvons le nommer en tant qu'hydrogène-2 ou 2H. Le deutérium est également un isotope stable d'hydrogène. Cependant, il n'est pas abondant par rapport à Protium. L'abondance varie entre 0.0026-0.0184%. Contrairement au tritium, le deutérium n'est pas radioactif. Il ne montre pas non plus la toxicité.
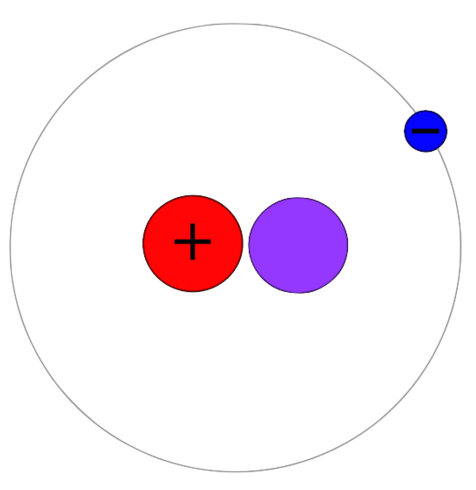
L'eau contient généralement de l'hydrogène-1 combinée avec des atomes d'oxygène. Mais il peut y avoir de l'hydrogène-2 combiné avec de l'oxygène, qui forme de l'eau. C'est de l'eau lourde. La formule chimique pour l'eau lourde est d2O où d est le deutérium et o est l'oxygène. De plus, nous pouvons utiliser le deutérium et ses composés dans des expériences chimiques. Par exemple, ils sont utiles comme étiquettes non radioactives dans des expériences telles que les solvants utilisés dans la spectroscopie RMN. De plus, nous pouvons utiliser l'eau lourde comme modérateur à neutrons et un liquide de refroidissement pour les réacteurs nucléaires. Le deutérium est également un carburant pour la fission nucléaire qui est effectué à l'échelle commerciale.
Quelle est la différence entre Protium et Deuterium?
Il y a trois isotopes d'hydrogène: protium, deutérium et tritium. La principale différence entre Protium et Deuterium est que Protium n'a pas de neutrons dans son noyau atomique, tandis que le deutérium a un neutron. Par conséquent, les trois isotopes diffèrent les uns des autres en fonction du nombre de neutrons présents dans leurs noyaux atomiques. De plus, pour cette raison, la masse atomique de protium est 1 tandis que la masse atomique du deutérium est 2.
De plus, nous pouvons désigner l'isotope protium comme hydrogène-1 ou 1H et l'isotope de deutérium comme hydrogène-2 ou 2H. Le protium est l'isotope d'hydrogène le plus abondant, et son abondance est d'environ 99%; Le deutérium est relativement moins abondant (environ 0.002%). Cependant, il est également stable comme Protium.
En dessous de l'infographie résume la différence entre Protium et Deuterium.

Résumé - Protium vs Deuterium
Il y a trois isotopes d'hydrogène: protium, deutérium et tritium. Ces trois isotopes diffèrent les uns des autres en fonction de la masse atomique, qui est le nombre de protons et de neutrons dans le noyau atomique. La principale différence entre Protium et Deuterium est que Protium n'a pas de neutrons dans son noyau atomique, tandis que le deutérium a un neutron.
Référence:
1. Helmenstine, Anne Marie. «Le Deuterium est-il radioactif?"Thoughtco, mai. 20, 2019, disponible ici.
Image gracieuseté:
1. «Hydrogène» par Mets501 - Propre travaux (CC BY-SA 3.0) via Commons Wikimedia
2. «H-2 Atom» de Zyjacklin - Propre travaux (CC0) via Commons Wikimedia


