Différence entre le phosgène et le diphosgéne
Le différence clé entre le phosgène et le diphosgéne est que Le phosgène a un atome de carbone, un atome d'oxygène et deux atomes de chlore tandis que le diphosgène a le double du nombre de tous ces atomes.
Le phosgène et le diphosgéne sont des composés organiques. Ces deux composés contiennent des atomes de carbone, d'oxygène et de chlore. Le nombre de chaque type d'atomes dans la molécule diphosgétique est exactement le deux fois le nombre de ces atomes dans la molécule de phosgène.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le phosgène
3. Qu'est-ce que le diphosgéne
4. Similitudes entre le phosgène et le diphosgéne
5. Comparaison côte à côte - phosgène vs diphosgéne sous forme tabulaire
6. Résumé
Qu'est-ce que le phosgène?
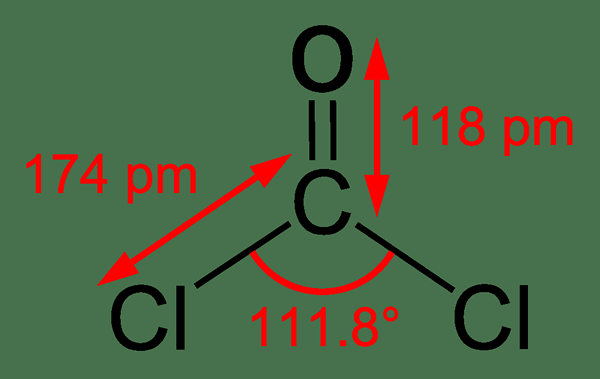
Le phosgène est un composé organique ayant la formule chimique COCl2. C'est un gaz incolore, et il a une odeur similaire à l'herbe fraîchement coupée. Bien qu'il soit insoluble dans l'eau, il peut réagir avec l'eau. De plus, il a une géométrie planaire trigonale et l'angle de liaison Cl-C-CL est 111.8 °. Ce composé est un simple chlorure d'acyle qui se forme à partir de l'acide carbonique.

Figure 01: La structure chimique de la molécule du phosgène
À l'échelle industrielle, nous produisons du phosgène en passant le monoxyde de carbone pur et le chlore gazeux par du carbone activé. Ici, le carbone activé est le catalyseur. De plus, cette réaction est exothermique, et nous devons refroidir le réacteur pendant la réaction. Lorsque vous envisagez les utilisations du phosgène, nous pouvons l'utiliser dans la production d'isocyanates, dans la synthèse des carbonates, etc.
Qu'est-ce que le diphosgéne?
Le diphosgéne est un composé organique ayant la formule chimique C2O2CL4. C'est un liquide incolore à température ambiante. C'est un réactif important dans les réactions de synthèse organique. Comparativement, le diphosgène a une faible toxicité que le phosgène. Cependant, ce liquide doit être manipulé soigneusement que le phosgène, qui est un gaz.
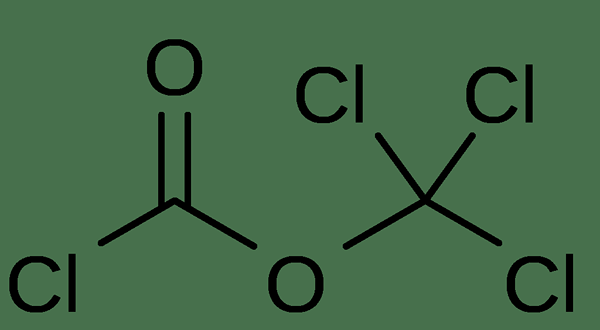
Figure 02: La structure chimique de la molécule diphosgétique
Nous pouvons préparer le diphosgène en laboratoire par chloration radicale du chloroformate de méthyle. Cette réaction nécessite la présence d'une source de rayonnement UV. En dehors de cela, la chloration radicale du formiate de méthyle peut également former le diphosgéne. De plus, le diphosgène se convertit en phosgène lorsqu'il est chauffé ou sur réaction avec le charbon de bois.
Quelles sont les similitudes entre le phosgène et le diphosgène?
- Le phosgène et le diphosgéne sont des composés organiques.
- Ces deux composés contiennent des atomes de carbone, d'oxygène et de chlore.
- Ces composés sont insolubles dans l'eau.
Quelle est la différence entre le phosgène et le diphosgène?
Le phosgène est un composé organique ayant la formule chimique COCl2 tandis que le diphosgéne est un composé organique ayant la formule chimique C2O2CL4. La principale différence entre le phosgène et le diphosgène est que le phosgène a un atome de carbone, un atome d'oxygène et deux atomes de chlore tandis que le diphosgène a le double du nombre de tous ces atomes.
Le phosgène se produit comme un gaz incolore avec une odeur similaire à celle de l'herbe fraîchement coupée tandis que le diphosgéne se produit comme un liquide incolore à température ambiante. Comparativement, le diphosgène est moins toxique que le phosgène, mais il doit être géré soigneusement parce que le diphosgéne a relativement une pression de vapeur élevée et se décompose pour former du phosgène à des températures élevées. De plus, le phosgène est produit en passant le monoxyde de carbone pur et le chlore gazeux à travers du carbone activé tandis que le diphosgéne est produit par chloration radicale du chloroformate de méthyle en présence d'une source de rayonnement UV.
Le tableau suivant résume la différence entre le phosgène et le diphosgène.
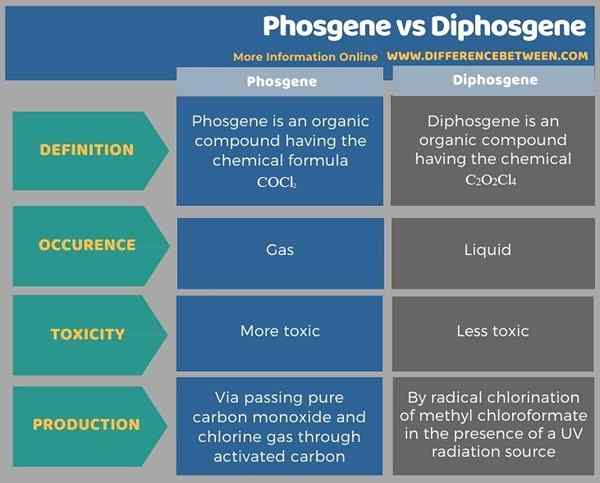
Résumé - Phosgène vs diphosgène
Le phosgène et le diphosgéne sont des composés organiques. Ces deux composés contiennent des atomes de carbone, d'oxygène et de chlore. La principale différence entre le phosgène et le diphosgène est que le phosgène a un atome de carbone, un atome d'oxygène et deux atomes de chlore tandis que le diphosgène a le double du nombre de tous ces atomes.
Référence:
«Diphosgéne.»Encyclopædia Britannica, Encyclopædia Britannica, Inc., 6 décembre. 2011, disponible ici.
«Diphosgéne.”Diphosgéne - un aperçu | ScienceDirect Sujets, disponibles ici.
Image gracieuseté:
1. «Phosgène-dimensions-2d» par phosgène-dimensions-2d.PNG: Ben Millssvg-Version: N-Regen - Phosgène-dimensions-2d.PNG (domaine public) via Commons Wikimedia
2. «Structure de diphosgéne» par ED (EDGAR181) - PROPRE WORK (DOMAINE PUBLIC) via Commons Wikimedia


