Différence entre l'ortho et le para hydrogène
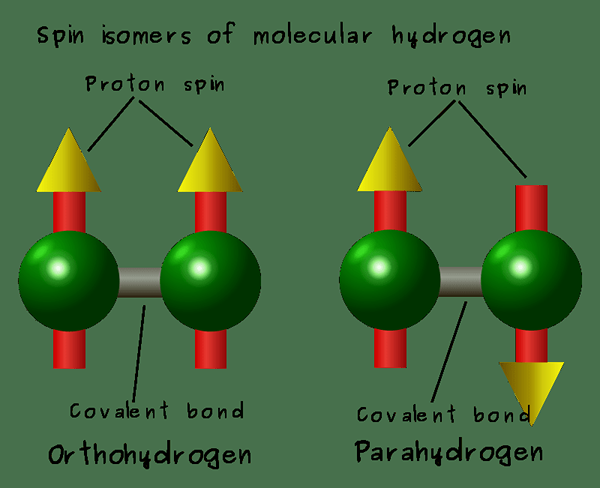
Le différence clé entre l'ortho et le para hydrogène est que Les molécules d'hydrogène ortho ont des spins de deux noyaux dans la même direction tandis que les molécules d'hydrogène para ont des spins de deux noyaux dans des directions opposées.
Hydrogène moléculaire dans une molécule d'hydrogène (h2) peut être trouvé sous deux formes sous forme d'hydrogène ortho et de para hydrogène. Nous les classons comme tels en fonction de l'alignement des tours nucléaires de ces atomes. Par conséquent, nous les appelons souvent des isomères de spin.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'ortho hydrogène
3. Qu'est-ce que para hydrogène
4. Comparaison côte à côte - ortho vs para hydrogène sous forme tabulaire
5. Résumé
Qu'est-ce que l'ortho hydrogène?
Les molécules d'hydrogène ortho sont les molécules de dihydrogène contenant des atomes d'hydrogène avec un spin nucléique dans la même direction. En d'autres termes, le spin de deux atomes est aligné parallèle les uns aux autres. C'est un isomère de spin de para hydrogène.

Figure 01: Comparaison de l'ortho et de l'hydrogène para
Cependant, cet isomère se produit dans un état d'énergie plus élevé que l'isomère para hydrogène. De plus, dans la spectroscopie RMN, l'ortho hydrogène forme un état de triplet.
Qu'est-ce que para hydrogène?
Les molécules de para hydrogène sont des molécules de dihydrogène contenant des atomes d'hydrogène avec un spin nucléique dans des directions opposées. Cela signifie la rotation nucléaire de chaque atome dans le H2 la molécule est opposée les unes aux autres. De plus, c'est un isomère de spin de l'hydrogène ortho. Les atomes de spin de deux atomes d'hydrogène sont également alignés antiparallèles. De plus, cet isomère se produit dans un état d'énergie inférieur que l'isomère ortho. De plus, dans la spectroscopie RMN, cet hydrogène donne un état singulet.
Quelle est la différence entre l'ortho et le para hydrogène?
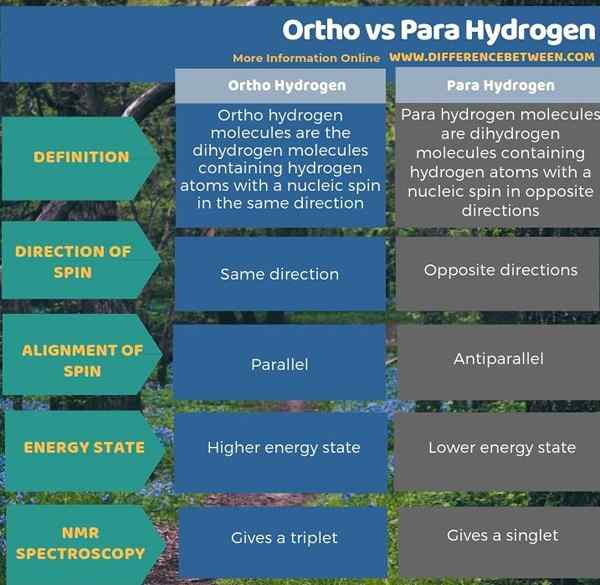
La principale différence entre l'ortho et le para hydrogène est que les molécules d'ortho hydrogène ont des spins de deux noyaux dans la même direction tandis que les molécules d'hydrogène para ont des spins de deux noyaux dans des directions opposées. Lorsque vous envisagez l'énergie de ces molécules, l'ortho hydrogène a un état d'énergie plus élevé que para hydrogène. De plus, dans la spectroscopie RMN, l'ortho-hydrogène donne un état de triplet tandis que le para hydrogène donne un état singulet.
Résumé - Ortho vs para hydrogène
Fondamentalement, l'ortho et l'hydrogène para sont deux types de h2 molécules que nous pouvons catégoriser en fonction de la rotation des atomes d'hydrogène. La principale différence entre l'ortho et le para hydrogène est que les molécules d'ortho hydrogène ont des spins de deux noyaux dans la même direction tandis que les molécules d'hydrogène para ont des spins de deux noyaux dans des directions opposées.
Référence:
1.«Ortho et para hydrogène.”Chemistry LibreTexts, LibreTexts, 5 juin 2019, disponible ici.
Image gracieuseté:
1. «Spinisomères de l'hydrogène moléculaire» par gkfxtalk (vectorisé), en: utilisateur: xaa (jim farris) (original) - vectorisé par moi-même (gkfxtalk) depuis également un fichier: spinisomers_of_mooleculaire_hydrogen.png (cc by-sa 3.0) via Commons Wikimedia


