Différence entre l'équation de Nernst et l'équation de Goldman
Le différence clé entre l'équation de Nernst et l'équation de Goldman est que L'équation de Nernst décrit la relation entre le potentiel de réduction et le potentiel d'électrode standard, tandis que l'équation de Goldman est une dérivée de l'équation de Nernst et décrit le potentiel d'inversion à travers une membrane cellulaire.
Une cellule électrochimique est un dispositif électrique qui peut produire de l'électricité en utilisant l'énergie chimique des réactions chimiques. Ou bien nous pouvons utiliser ces appareils pour aider les réactions chimiques en fournissant l'énergie requise de l'électricité. Le potentiel de réduction d'une cellule électrochimique détermine la capacité de la cellule à produire de l'électricité.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'équation Nernst
3. Qu'est-ce que l'équation Goldman
4. Comparaison côte à côte - Équation de Nernst vs. Équation Goldman sous forme tabulaire
5. Résumé
Qu'est-ce que l'équation Nernst?
L'équation de Nernst est une expression mathématique qui donne la relation entre le potentiel de réduction et le potentiel de réduction standard d'une cellule électrochimique. L'équation est nommée d'après le scientifique Walther Nernst. Et, il a été développé en utilisant les autres facteurs affectant les réactions électrochimiques d'oxydation et de réduction, telles que la température et l'activité chimique des espèces chimiques qui subissent l'oxydation et la réduction.

Lors de la dérivation de l'équation de Nernst, nous devons considérer les changements standard de l'énergie libre de Gibbs qui est associée aux transformations électrochimiques qui se produisent dans la cellule. La réaction de réduction d'une cellule électrochimique peut être donnée comme suit:
Bœuf + z e- ⟶ Rouge
Selon la thermodynamique, le changement d'énergie libre réel de la réaction est,
E = eréduction - Eoxydation
Cependant, l'énergie libre de Gibbs (ΔG) est liée à la différence E (différence de potentiel) comme suit:
Δg = -nfe
Où n est le nombre d'électrons transférés entre les espèces chimiques lorsque la réaction progresse, F est la constante de Faraday. Si nous considérons les conditions standard, alors l'équation est la suivante:
ΔG0 = -Nfe0
Nous pouvons relier l'énergie libre de Gibbs des conditions non standard avec l'énergie Gibbs des conditions standard via l'équation suivante.
Δg = Δg0 + Rtlnq
Ensuite, nous pouvons remplacer les équations ci-dessus dans cette équation standard pour obtenir l'équation de Nernst comme suit:
-nfe = -nfe0 + Rtlnq

Cependant, nous pouvons réécrire l'équation ci-dessus en utilisant les valeurs de Faraday constante et r (constante de gaz universelle).
E = e0 - (0.0592vlnq / n)
Qu'est-ce que l'équation Goldman?
L'équation de Goldman est utile pour déterminer le potentiel inverse à travers une membrane cellulaire en physiologie de la membrane cellulaire. Cette équation a été nommée d'après le scientifique David E. Goldman, qui a développé l'équation. Et, il était dérivé de l'équation de Nernst. L'équation de Goldman prend en compte la distribution inégale des ions à travers la membrane cellulaire et les différences de perméabilité de la membrane lors de la détermination de ce potentiel inverse. L'équation est la suivante:
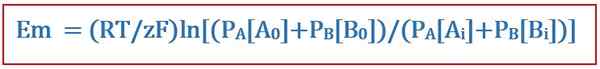
Où
- EM est la différence de potentiel à travers la membrane cellulaire,
- R est la constante de gaz universelle,
- T est la température thermodynamique,
- Z est le nombre de moles d'électrons qui sont transférés entre les espèces chimiques,
- F est la constante de Faraday,
- PA ou B est la perméabilité de la membrane vers une ou b ion, et
- [A ou B]je est la concentration d'une ou b ion à l'intérieur de la membrane cellulaire.
Quelle est la différence entre l'équation Nernst et l'équation de Goldman?
L'équation de Nernst et l'équation de Goldman sont des expressions mathématiques qui peuvent être utilisées comme mesures du potentiel des cellules électrochimiques. La principale différence entre l'équation de Nernst et l'équation de Goldman est que l'équation de Nernst décrit la relation entre le potentiel de réduction et le potentiel d'électrode standard, tandis que l'équation de Goldman est un dérivé de l'équation de Nernst et décrit le potentiel d'inversion à travers une membrane cellulaire.
L'infographie ci-dessous résume la différence entre l'équation de Nernst et l'équation de Goldman.

Résumé - Équation de Nernst contre l'équation de Goldman
L'équation de Nernst et l'équation de Goldman sont des expressions mathématiques qui peuvent être utilisées comme mesures du potentiel des cellules électrochimiques. La principale différence entre l'équation de Nernst et l'équation de Goldman est que l'équation de Nernst décrit la relation entre le potentiel de réduction et le potentiel d'électrode standard, mais l'équation de Goldman est une dérivée de l'équation de Nernst et décrit le potentiel d'inversion à travers une membrane cellulaire.
Référence:
1. «Équation de Nernst.”Chemistry LibreTexts, LibreTexts, 5 juin 2019, disponible ici.
Image gracieuseté:
1. «ElectrochemCell» par Alksub au Wikipedia anglais (CC By-SA 3.0) via Commons Wikimedia


