Différence entre la molarité et la molité

Le différence clé entre la molarité et la molialité est que la molarité est Le nombre de moles de soluté présents dans 1 litre de solution tandis que la molalité est le nombre de moles de soluté présent dans 1 kg de solvant.
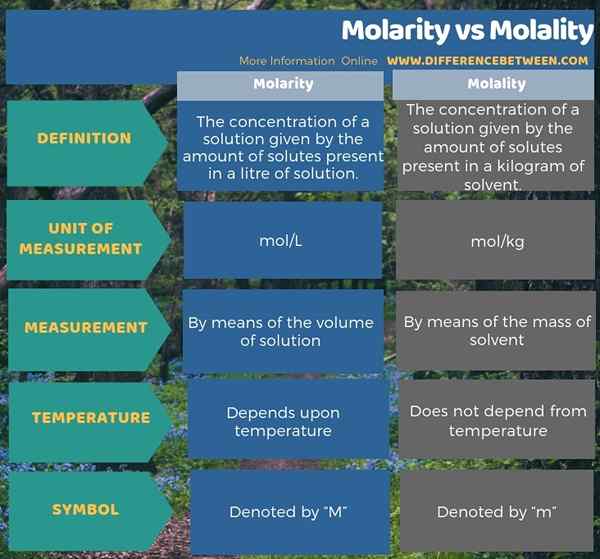
La molarité et la molalité sont des mesures des concentrations de solutions. La concentration d'une solution donne la quantité de solutés dissous dans une quantité unitaire de solution. Les deux mesures sont différentes les unes des autres en fonction du paramètre que nous utilisons pour mesurer la quantité unitaire de solution; La molarité considère le volume de la solution tandis que la molalité considère la masse du solvant. Cependant, dans les deux cas, nous mesurons le nombre de solutés dans les taupes.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la molarité
3. Qu'est-ce que la molalité
4. Comparaison côte à côte - Mollarité vs Molality sous forme tabulaire
5. Résumé
Qu'est-ce que la molarité?
La molarité est la concentration d'une solution donnée par le nombre de solutés présents dans un litre de solution. Par conséquent, nous mesurons la concentration d'une solution au moyen du volume lors de la détermination de la molarité. L'unité de mesure est mol / L.

Figure 01: Différentes solutions ont des concentrations différentes en fonction du volume de la solution
De plus, ce paramètre dépend de la température de la solution car le volume d'une solution peut varier avec la température, i.e. Presque toutes les fois où le volume de liquides se dilate avec une température croissante. Par exemple, une solution contenant deux moles de soluté dissous dans un litre de solution a 2.0 mol / L Concentration. Nous pouvons désigner la molarité par «M».
Qu'est-ce que la molalité?
La molalité est la concentration d'une solution donnée par la quantité de solutés présents dans un kilogramme de solvant. Par conséquent, nous mesurons la concentration d'une solution au moyen de la masse de solvant lors de la détermination de la molalité de la solution. Par conséquent, l'unité de mesure est mol / kg.
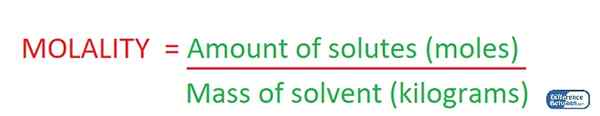
Figure 02: Détermination de la molialité d'une solution
De plus, ce paramètre ne dépend pas de la température de la solution car la masse ne change pas avec la température. Par exemple, si une solution contient 2 moles de solutés dissous dans un kilogramme de solvant, alors la concentration est 2.0 mol / kg. Nous désignons généralement ce terme comme «M».
Quelle est la différence entre la molarité et la molalité?
La molarité est la concentration d'une solution donnée par la quantité de solutés présents dans un litre de solution tandis que la molialité est la concentration d'une solution donnée par la quantité de solutés présents dans un kilogramme de solvant. Par conséquent, c'est la principale différence entre la molarité et la molialité. De plus, une différence importante entre la molarité et la molalité est que la molarité dépend de la température d'une solution tandis que la molialité est indépendante de la température. C'est principalement parce que le volume peut se développer avec l'augmentation de la température alors que la masse reste constante lors des changements de température.
L'infographie ci-dessous montre la différence entre la molarité et la molalité sous forme tabulaire.
Résumé - Mollarité vs Molality
La molarité et la molalité sont des mesures des concentrations de solutions. La principale différence entre la molarité et la molalité est que la molarité est le nombre de moles de soluté présents dans 1 litre de solution tandis que la molalité est le nombre de moles de soluté présent dans 1 kg de solvant.
Référence:
1. Mott, Valerie. «Introduction à la chimie.»Lumen. Disponible ici
2. «Concentration molaire.»Wikipedia, Wikimedia Foundation, 17 octobre. 2018. Disponible ici
Image gracieuseté:
1.”217043" par public


