Différence entre la solubilité molaire et la constante de solubilité du produit

Le différence clé entre la solubilité molaire et la constante de solubilité du produit est que le La solubilité molaire décrit la dissolution d'une substance par litre d'une solution, tandis que la constante de solubilité du produit décrit la dissolution d'une substance solide dans une solution aqueuse.
La solubilité molaire et la constante de solubilité du produit sont des concepts chimiques qui décrivent la dissolution des substances dans les solutions. Nous pouvons calculer la solubilité molaire à partir de la solubilité du produit constant. Par conséquent, ils sont liés les uns aux autres.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la solubilité molaire
3. Quelle est la constante de solubilité du produit
4. Comparaison côte à côte - solubilité molaire et solubilité du produit constante dans la forme tabulaire
5. Résumé
Qu'est-ce que la solubilité molaire?
La solubilité molaire est le nombre de moles d'une substance qui se dissout par litre d'une solution avant saturation. Cela signifie; La solubilité molaire donne la quantité d'une substance que nous pouvons dissoudre dans une solution avant que la solution ne soit saturée de cette substance particulière. Nous pouvons calculer ce montant en utilisant la constante de solubilité du produit ou le KSP et la stoechiométrie. L'unité de la solubilité molaire est MOL / L. Nous pouvons désigner ce terme comme «M». Nous pouvons calculer la solubilité molaire en utilisant KSP, mais nous devons connaître les ions produits par la dissociation pendant la dissolution de la substance dans la solution.

Analysons un exemple; Si AB est dissous dans une solution aqueuse, il se dissocie en produits A et B ioniques. L'équation de cette dissolution est la suivante:
UN B(S) ⇌ A(aq) + B(aq)
Selon la stoechiométrie de cette réaction, si la concentration finale de A est «x», alors la concentration finale de B est également «x». Ensuite, l'équation du produit de solubilité pour cette réaction est;
Ksp = [a] [b]
= [x] [x]
= x2
Ici, x est la solubilité molaire. Par conséquent, si nous connaissons le KSP de la réaction, nous pouvons calculer la solubilité x, molaire de la réaction.
Quelle est la constante de solubilité du produit?
Constante de solubilité du produit ou constante de produit de solubilité est la constante d'équilibre pour la dissolution d'une substance solide dans une solution aqueuse. Par conséquent, il décrit la dissolution d'une substance solide dans une solution aqueuse, et il représente le niveau auquel un soluté se dissout dans une solution. Nous pouvons le désigner comme KSP. Généralement, le KSP est calculé en multipliant les concentrations de produits ioniques après la dissolution de la substance. Pour la dissolution de l'ab2, La réaction est la suivante:
UN B2 (s) ⇌ A(aq) + 2B(aq)
Pour la réaction ci-dessus, la constante de solubilité du produit ou le KSP est la suivante:
Ksp = [a(aq)] [B(aq)]]2
Quelle est la différence entre la solubilité molaire et la constante de solubilité du produit?
Les deux, la solubilité molaire et la solubilité du produit constant, décrivent la dissolution d'une substance dans une solution. Cependant, la principale différence entre la solubilité molaire et la constante de solubilité du produit est que la solubilité molaire décrit la dissolution d'une substance par litre d'une solution, tandis que la constante de solubilité du produit décrit la dissolution d'une substance solide dans une solution aqueuse.
En outre, la solubilité molaire est le nombre de moles d'une substance qui se dissout par litre d'une solution avant saturation. Pendant ce temps, la constante de solubilité du produit est, ou la constante de produit de solubilité est la constante d'équilibre pour la dissolution d'une substance solide dans une solution aqueuse. Nous pouvons désigner la solubilité molaire comme «M» et la solubilité du produit constant en tant que «KSP».
L'infographie ci-dessous résume la différence entre la solubilité molaire et la constante de solubilité du produit.
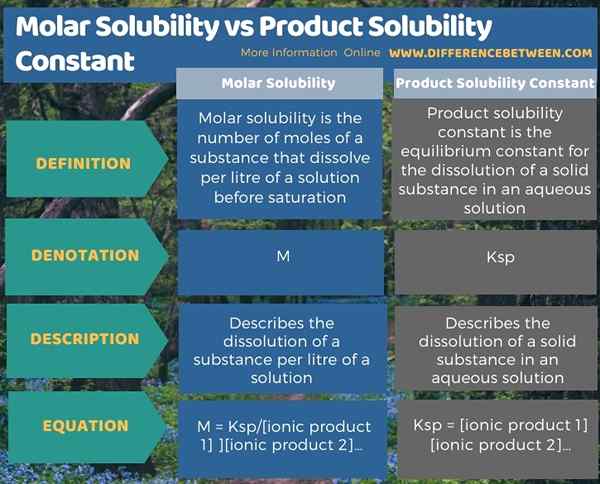
Résumé - Solubilité molaire vs constante de solubilité du produit
En résumé, à la fois la solubilité molaire et la solubilité du produit constant, décrivent la dissolution d'une substance dans une solution. Cependant, la principale différence entre la solubilité molaire et la constante de solubilité du produit est que la solubilité molaire décrit la dissolution d'une substance par litre d'une solution, tandis que la constante de solubilité du produit décrit la dissolution d'une substance solide dans une solution aqueuse.
Référence:
1. «Produit de solubilité constant, KSP.”Chemistry LibreTexts, LibreTexts, 5 juin 2019, disponible ici.
2. «Solubilité molaire.»Wikipedia, Wikimedia Foundation, 5 avril. 2019, disponible ici.
3. «Équilibre de solubilité.»Wikipedia, Wikimedia Foundation, 26 septembre. 2019, disponible ici.


