Différence entre Mendeleev et Tableau périodique moderne

Le différence clé Entre Mendeleev et le tableau périodique moderne est que La base du tableau périodique moderne est principalement la configuration électronique des éléments, que nous appelons le numéro atomique alors que, dans le tableau périodique de Mendeleev, c'est la masse atomique des éléments.
Voyons ici quel est le tableau périodique de Mendeleev et ce qu'est un tableau périodique moderne, puis comparez les deux pour comprendre la différence entre Mendeleev et le tableau périodique moderne. Mendeleev est le pionnier du tableau périodique moderne, après un nombre de modifications de l'ancienne version du tableau périodique. Ces deux tentatives sont tout aussi importantes pour la communauté scientifique; Parce que sans une invention de la relation périodique dans les éléments, les développements modernes de la science n'atteindraient pas une époque de développement comme aujourd'hui.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le tableau périodique de Mendeleev
3. Qu'est-ce que le tableau périodique moderne
4. Comparaison côte à côte - Mendeleev vs Tableau périodique moderne sous forme tabulaire
5. Résumé
Qu'est-ce que le tableau périodique de Mendeleev?
En 1869, un chimiste russe Dmitri Mendeleev et un chimiste allemand Lothar Meyer ont proposé une tabulation d'éléments périodiques sur la base de la récidive périodique des propriétés. En 1864, avant Mendeleev, un chimiste anglais John Newlands a organisé les éléments par ordre de masse atomique où tous les huit éléments ont des propriétés similaires. Il a qualifié la relation particulière de «loi des octaves». Cependant, nous ne pouvons pas faire sa loi pour les éléments au-delà du calcium. Par conséquent, la communauté scientifique ne l'a pas accepté.

Figure 01: Tableau périodique de Mendeleev
Comparé à la classification de Newland, le système de classification de Mendeleev a une grande amélioration pour deux raisons. Le premier facteur est qu'il a regroupé les éléments plus précisément en fonction de leurs propriétés. Deuxièmement, il a fait la prédiction possible des propriétés de plusieurs éléments non découverts. Par exemple, Mendeleev a proposé l'existence d'un élément inconnu appelé eka-aluminium et prédit un certain nombre de ses propriétés. (Le sens EKA en sanskrit est `` premier ''. Ainsi, l'EKA-aluminium est le premier élément du groupe en aluminium). Lorsque les scientifiques ont découvert le gallium après quatre ans, ses propriétés correspondaient remarquablement aux propriétés prévues de l'eka-aluminium.
Ainsi, mentionner ceux-ci serait le suivant;

Dans le tableau périodique de Mendeleev, 66 éléments sont là. En 1900, 30 autres éléments que des scientifiques ont ajouté à la liste, remplissant certains des espaces vides du tableau.
Qu'est-ce que le tableau périodique moderne?
Le tableau périodique moderne considère la configuration électronique à l'état fondamental le plus externe des éléments. Selon le type de sous-coquille qui se remplit d'électrons, nous pouvons diviser les éléments en catégories; les éléments représentatifs, les gaz nobles, les éléments de transition (ou les métaux de transition) et les actinides. Les éléments représentatifs sont (nous les appelons les principaux éléments du groupe) les groupes en IA à 7A, que tous les éléments ont des sous-coquilles S ou P incomplètement remplies du numéro quantique le plus élevé. À l'exception de l'hélium (il), tous les éléments 8A ont rempli P-Subshell.
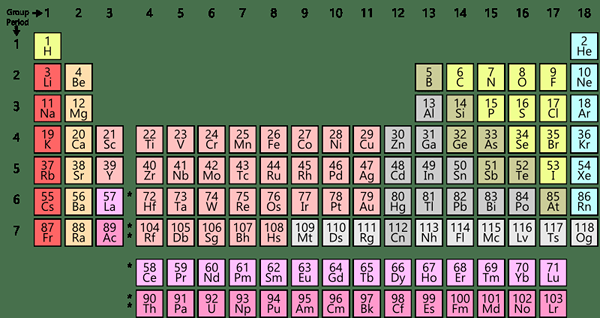
Figure 02: Tableau périodique moderne
Les métaux de transition sont les éléments de 1b et 3b à 8b, où les molécules ont des sous-planches D incomplètement remplies. Les lanthanides et les actinides sont parfois appelés éléments F-Block car ces éléments ont des orbitales F incomplètes.
Quelle est la différence entre Mendeleev et Tableau périodique moderne?
Le tableau périodique de Mendeleev est la base du tableau périodique moderne que nous utilisons aujourd'hui. Il a 65 éléments connus, mais avec les éléments nouvellement découverts, il y a 103 éléments dans le tableau périodique moderne. La principale différence entre Mendeleev et le tableau périodique moderne est que la base du tableau périodique moderne est principalement la configuration électronique des éléments, que nous appelons le numéro atomique tandis que le tableau périodique de Mendeleev considère la masse atomique des éléments.
L'infographie ci-dessous tabule la différence entre Mendeleev et le tableau périodique moderne en détail.

Résumé - Mendeleev vs Tableau périodique moderne
Les éléments aux propriétés chimiques et physiques similaires se reproduisent à des intervalles définis dans le tableau périodique moderne, et il a environ 103 éléments. Lorsque Mendeleev les a classés, il n'y avait que 66 éléments dans le tableau périodique. Cependant, Mendeleev gauche des endroits vide dans sa table périodique pour les éléments non découverts. Il a également assumé la variation périodique des propriétés des éléments. La principale différence entre Mendeleev et le tableau périodique moderne est que la base du tableau périodique moderne est principalement la configuration électronique des éléments, que nous appelons le numéro atomique tandis que le tableau périodique de Mendeleev considère la masse atomique des éléments.
Référence:
1. LibreTexts. «3.1: le tableau périodique de Mendeleev.”Chemistry LibreTexts, LibreTexts, 14 octobre. 2016. Disponible ici
2. "Tableau périodique.»Wikipedia, Wikimedia Foundation, 7 octobre. 2018. Disponible ici
Image gracieuseté:
1.»Tableau périodique de Mendeleev, 1871" par Niknaks - Propre travaux, (domaine public) via Commons Wikimedia
2.«Tableau périodique simple-Enf-en» par offnfopt - propre travail, (domaine public) via Commons Wikimedia


