Différence entre la chaleur latente de la fusion et la vaporisation
Le différence clé entre la chaleur latente de la fusion et de la vaporisation est que La chaleur de fusion latente est la quantité de chaleur qu'une substance solide nécessite pour changer sa phase de la phase solide à la phase liquide à une température constante tandis que la chaleur latente de vaporisation est la quantité de chaleur qu'une substance liquide nécessite de changer sa phase à partir de la phase liquide à la phase de vapeur à une température constante.
La chaleur latente de la fusion et de la vaporisation se réfère au changement d'énergie thermique à des températures constantes. La chaleur latente de la fusion décrit le changement de chaleur au point de fusion d'une substance. Au contraire, la chaleur latente de vaporisation décrit le changement de chaleur au point d'ébullition d'une substance. De même, il existe quelques différences entre les deux concepts chimiques.
CONTENU
1. Aperçu et différence clé
2. Quelle est la chaleur latente de la fusion
3. Quelle est la chaleur latente de la vaporisation
4. Comparaison côte à côte - chaleur latente de fusion vs vaporisation sous forme tabulaire
5. Résumé
Quelle est la chaleur latente de la fusion?
La chaleur latente de la fusion est la quantité de chaleur qu'une substance solide nécessite pour changer sa phase de la phase solide à la phase liquide à une température constante, indiquée par HF. En d'autres termes, une masse unitaire d'une substance nécessite une énergie thermique qui est égale à la chaleur latente de fusion (de cette substance particulière) à son point de fusion, afin de se convertir en sa phase liquide. La fusion fait fondre (liquéfier un solide en fournissant de la chaleur). Différentes substances ont des points de fusion différents; Ainsi, différentes valeurs pour hF.
Équation de la chaleur latente de la fusion
L'équation de HF est comme suit:
HF = ΔQF/ m
Ici, ΔQFLe changement dans l'énergie de la substance et m est la masse de la substance.
Quelle est la chaleur latente de la vaporisation?
La chaleur latente de vaporisation est la quantité de chaleur dont une substance liquide nécessite de changer sa phase de la phase liquide en phase de vapeur à une température constante, indiquée par HV. En d'autres termes, une masse unitaire d'une substance nécessite une énergie thermique égale à la chaleur latente de vaporisation (de cette substance particulière) à son point d'ébullition, afin de se convertir en phase gazeuse.

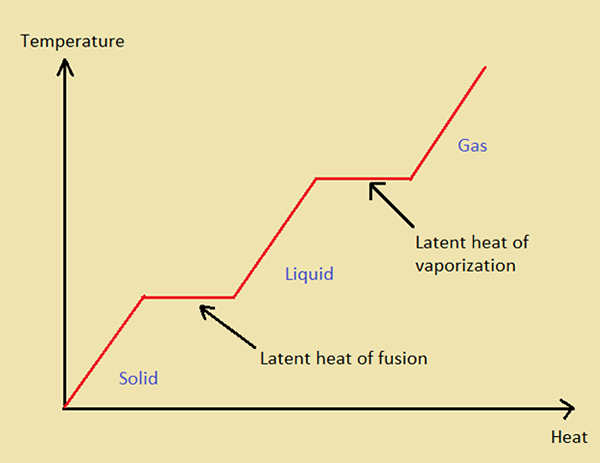
Figure 01: Graphique indiquant la chaleur latente de la fusion et de la vaporisation
Équation de la chaleur latente de vaporisation
L'équation de HV est comme suit:
HV = ΔQV/ m
Ici ΔQV Le changement dans l'énergie de la substance et m est la masse de la substance.
Quelle est la différence entre la chaleur latente de la fusion et la vaporisation?
La chaleur latente de la fusion est la quantité de chaleur qu'une substance solide nécessite pour changer sa phase de la phase solide à la phase liquide à une température constante tandis que la chaleur latente de vaporisation est la quantité de chaleur qu'une substance liquide a besoin pour changer sa phase du liquide phase à phase de vapeur à une température constante.
La chaleur latente de la fusion est indiquée par HF tandis que la chaleur latente de vaporisation est indiquée par Hy . En ce qui concerne la température constante, la chaleur latente de la fusion est au changement de chaleur au point de fusion d'une substance tandis que la chaleur latente de vaporisation se réfère au changement de chaleur au point d'ébullition d'une substance.

Résumé - chaleur latente de la fusion vs vaporisation
La chaleur latente se réfère au changement de chaleur à une température constante. Différentes substances ont des chaleurs latentes différentes à leurs points de fusion et points d'ébullition. La différence entre la chaleur latente de la fusion et de la vaporisation est qu'une substance passe à sa phase de solide au liquide lorsque nous fournissons une quantité de chaleur égale à la chaleur latente de fusion alors qu'une substance change sa phase de liquide à vapeur lorsque nous fournissons un quantité de chaleur égale à la chaleur latente de vaporisation.
Référence:
1. "Chaleur latente.«La loi d'Ohm. Disponible ici
2. «Vous êtes redirigé…» Les théories physiques lois des concepts et ressources de base avec toutes les branches. Disponible ici


