Différence entre l'isocyanate et le diisocyanate
Le différence clé entre l'isocyanate et le diisocyanate L'isocyanate est un groupe fonctionnel ayant un atome d'azote, un atome de carbone et un atome d'oxygène lié respectivement via les doubles liaisons tandis que le diisocyanate est un composé ayant deux anions d'isocyanate ou des groupes fonctionnels.
L'isocyanate et le diisocyanate sont similaires parce qu'un composé diisocyanate se forme à partir de la combinaison de deux groupes d'isocyanate. C'est ainsi que le nom diisocyanate se forme: «Di-» préfixe est utilisé pour exprimer le sens «deux."
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'isocyanate
3. Qu'est-ce que le diisocyanate
4. Comparaison côte à côte - isocyanate vs diisocyanate sous forme tabulaire
5. Résumé
Qu'est-ce que l'isocyanate?
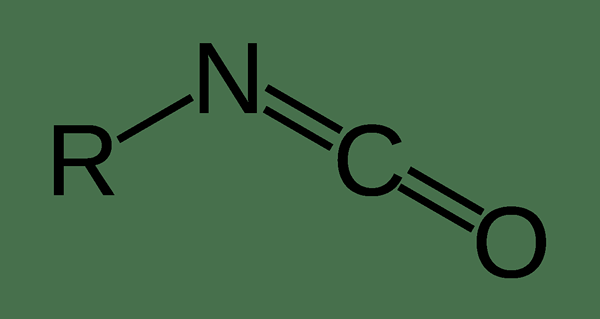
L'isocyanate est un groupe fonctionnel ayant la formule chimique n = c = o. Par conséquent, nous pouvons donner la formule chimique d'un composé d'isocyanate comme r-n = c = o. Généralement, les composés organiques contenant un groupe d'isocyanate sont généralement nommés comme un isocyanate. De même, s'il y a deux groupes d'isocyanate dans un composé organique, nous pouvons l'appeler diisocyanate. De plus, il est important de faire la différence entre les esters de cyanate et les isocyanures car ils ont une ressemblance étroite. Ici, le groupe fonctionnel du cyanate ester a un arrangement différent de celui du groupe isocyanate; Le groupe cyanate a une structure O-C≡N tandis que l'isocyanate a une structure o = c = n.

Figure 01: Structure d'un composé contenant de l'isocyanate
La structure de l'isocyanate est étroitement similaire à la structure d'une molécule de dioxyde de carbone. En effet.
Nous pouvons produire des composés d'isocyanate à l'aide d'amines via la phosgénation. Par exemple, nous pouvons traiter les amines avec du phosgène pour obtenir de l'isocyanate et de l'acide chlorhydrique comme produits. Cette réaction, cependant, se déroule via un intermédiaire (un composé de chlorure de carbonyle organique). De plus, l'utilisation du phosgène est dangereuse, nous devons donc prendre des précautions lors de la préparation de l'isocyanate dans cette méthode.
Lorsque vous envisagez la réactivité des isocyanates, ces composés peuvent agir comme des électrophiles. Par conséquent, ils sont réactifs vers une variété de nucléophiles, y compris les alcools, les amines et l'eau. Par exemple, la réaction entre un isocyanate et un alcool produit une liaison uréthane. Cependant, si nous avons besoin d'obtenir du polyuréthane, il devrait y avoir deux groupes d'isocyanate par molécule pour obtenir une structure polymérisée; Le diisocyanate est utilisé dans ce cas.
Qu'est-ce que le diisocyanate?
Le diisocyanate est un terme utilisé pour nommer des composés chimiques ayant deux groupes d'isocyanate par molécule. Cela signifie que ces composés ont deux groupes n = c = o. Dans ces composés, les deux groupes d'isocyanate peuvent se produire sous forme d'anions ou de groupes fonctionnels. Les diisocyanates sont utiles dans la production de polyuréthanes car il existe deux groupes d'isocyanate qui peuvent former deux liaisons d'uréthane par molécule pour former une structure polymérisée.
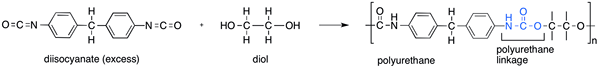
Figure 02: Formation de polyuréthane à l'aide d'un diol et d'un diisocyanate
Dans ce processus de polymérisation de production de polyuréthane, le composé de diisocyanate doit être traité avec un composé organique contenant deux groupes hydroxyles ou plus. E.g. diols, polyols, etc. L'équation générale de la formation de polyuréthane est la suivante:
Quelle est la différence entre l'isocyanate et le diisocyanate?
L'isocyanate et le diisocyanate sont étroitement similaires parce qu'un composé diisocyanate se forme à partir de la combinaison de deux groupes d'isocyanate. Par conséquent, la principale différence entre l'isocyanate et le diisocyanate est que l'isocyanate est un groupe fonctionnel ayant un atome d'azote, un atome de carbone et un atome d'oxygène lié respectivement via des liaisons doubles tandis que le diisocyanate est un composé ayant deux anions d'isocyanate ou des groupes fonctionnels.
Ci-dessous, l'infographie tabule les différences entre l'isocyanate et le diisocyanate.

Résumé - Isocyanate vs diisocyanate
Les termes isocyanate et diisocyante sont utilisés pour discuter de la préparation du polyuréthane. En effet. La principale différence entre l'isocyanate et le diisocyanate est que l'isocyanate est un groupe fonctionnel ayant un atome d'azote, un atome de carbone et un atome d'oxygène lié respectivement via des liaisons doubles tandis que le diisocyanate est un composé ayant deux anions d'isocyanate ou des groupes fonctionnels.
Référence:
1. Isocyanate. (2020, 13 août). Récupéré le 31 août 2020, disponible ici.
Image gracieuseté:
1. «Group isocyanate» par fvasconcellos (talk · contribs) - version vectorielle de l'image: groupe isocyanate.PNG par Ben Mills. (Domaine public) via Commons Wikimedia
2. «Synthèse en polyuréthane» par RLM0518 - Propre travaux (CC BY-SA 3.0) via Commons Wikimedia


