Différence entre le processus isobare et isochorique
Le différence clé entre le processus isobare et isochorique est que le Le processus isobare se produit à une pression constante tandis que le processus isochorique se produit à un volume constant.
Un processus thermodynamique est un processus chimique ou physique qui se déroule dans un système thermodynamique, qui change le système d'un état initial à un état final. Il existe différentes formes de processus thermodynamiques. Les processus isobariques et isochoriques sont deux de ces processus.
CONTENU
1. Aperçu et différence clé
2. Quel est le processus isobare
3. Quel est le processus isochorique
4. Comparaison côte à côte - processus isobare vs isochorique sous forme tabulaire
5. Résumé
Quel est le processus isobare?
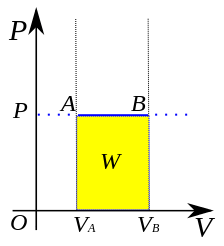
Un processus isobare est un processus chimique qui se déroule dans un système thermodynamique sous pression constante. Par conséquent, le changement de pression ou ∆P est nul. Habituellement, le système maintient la pression constante en permettant au volume du système de changer; cela peut être soit une expansion, soit une contraction. Ce changement de volume peut neutraliser les changements de pression qui peuvent se produire en raison du transfert de chaleur entre le système et l'environnement.

Figure 01: Le travail effectué dans un processus isobare (zone jaune)
En règle générale, dans un processus isobare, l'énergie interne (U) change. Par conséquent, le travail (w) est effectué par le système pendant le transfert de chaleur. Nous pouvons calculer le travail à pression constante en utilisant l'équation suivante.
W = p * ∆v
Ici, w est le travail, P est la pression et ∆v est le changement de volume. Ainsi, si le transfert de chaleur provoque une expansion du volume du système, le système fait un travail positif tandis que si le transfert de chaleur provoque un contrat du volume du système, alors le système fait un travail négatif.
Quel est le processus isochorique?
Le processus isochorique est un processus chimique qui se déroule dans un système thermodynamique sous un volume constant. Par conséquent, il n'y a aucun changement de volume; ∆V est nul. Étant donné que le volume reste constant, le travail effectué par le système est nul; Ainsi le système ne fonctionne pas. La plupart du temps, c'est la variable thermodynamique la plus simple à contrôler. Le processus se produit dans un récipient scellé qui ne se développe ni ne contracte.
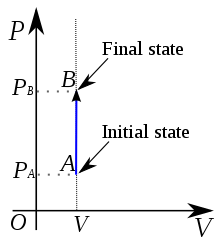
Figure 02: processus isochorique
L'énergie interne du système thermodynamique change en fonction du transfert de chaleur. Cependant, toute la chaleur transférée augmente ou diminue l'énergie interne. Puisque ∆v est nul, le travail effectué par le système (ou le travail effectué sur le système) est également zéro. Si u est l'énergie interne et Q est la chaleur transférée;
∆u = q
Quelle est la différence entre le processus isobare et isochorique?
Le processus isobare est un processus chimique qui se déroule dans un système thermodynamique sous pression constante tandis que le processus isochorique est un processus chimique qui se déroule dans un système thermodynamique sous un volume constant. C'est la principale différence entre le processus isobare et isochorique. Cela signifie que la pression du système thermodynamique reste inchangée pendant un processus isobare tandis que la pression change en conséquence dans un processus isochorique. En plus de cela, le volume du système thermodynamique change pendant un processus isobare tandis que le volume reste constant pendant un processus isochorique. Cependant, dans les deux processus, l'énergie interne du système change. Mais contrairement au processus isobare, pendant un processus isochorique, toute la chaleur transférée soit convertie en énergie interne ou provient d'énergie interne.
L'infographie ci-dessous présente plus de détails sur la différence entre le processus isobare et isochorique sous forme tabulaire.
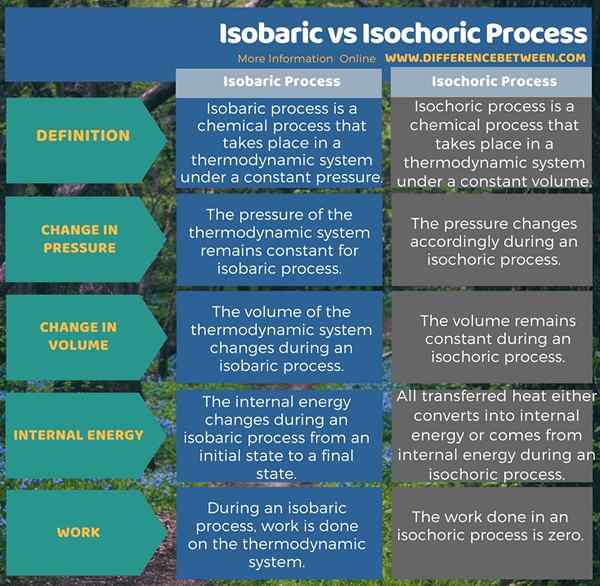
Résumé - Processus isobarique vs isochorique
Les processus isobares et isochoriques sont des processus thermodynamiques qui se déroulent dans les systèmes thermodynamiques tout en gardant un paramètre constant. Par conséquent, la différence entre le processus isobare et isochorique est que le processus isobare se produit à une pression constante tandis que le processus isochorique se produit à un volume constant.
Référence:
1. Jones, Andrew Zimmerman. «Le processus isochorique.”Thoughtco, Jun. 22, 2018. Disponible ici
2. Jones, Andrew Zimmerman. «Sous pression constante: comprendre les processus isobariques.”Thoughtco, Thoughtco. Disponible ici
Image gracieuseté:
1.«Isobaric Process Plain» par Ikamusumefan - Propre travaux, (CC BY-SA 3.0) via Commons Wikimedia
2.«Isochoric Process SVG» par Ikamusumefan - Propre travaux, (CC BY-SA 3.0) via Commons Wikimedia