Différence entre les liaisons ioniques et covalentes
Le différence clé entre les liaisons ioniques et covalentes est que Des liaisons ioniques se produisent entre les atomes ayant des électronégativités très différentes tandis que les liaisons covalentes se produisent entre les atomes avec des différences d'électronégativité similaires ou très faibles.
Comme proposé par le chimiste américain G.N.Lewis a proposé que les atomes soient stables lorsqu'ils contiennent huit électrons dans leur coquille de valence. La plupart des atomes ont moins de huit électrons dans leurs coquilles de valence (à l'exception des gaz nobles dans le groupe 18 du tableau périodique); Par conséquent, ils ne sont pas stables. Ces atomes ont tendance à réagir les uns avec les autres pour devenir stables. Ainsi, chaque atome peut atteindre une configuration électronique à gaz noble. Les liaisons ioniques et covalentes sont les deux principaux types de liaisons chimiques, qui relient les atomes dans un composé chimique.

CONTENU
1. Aperçu et différence clé
2. Que sont les liens ioniques
3. Whare est des obligations covalentes
4. Comparaison côte à côte - liaisons ioniques vs covalentes sous forme tabulaire
5. Résumé
Que sont les liens ioniques?
Les atomes peuvent gagner ou perdre des électrons et former des particules chargées négatives ou positives; que nous appelons les ions. Il y a des interactions électrostatiques entre les ions. Le lien ionique est la force d'attraction entre ces ions chargés de facturation. Les électronégativités des atomes dans une liaison ionique influencent largement la force des interactions électrostatiques entre les ions.

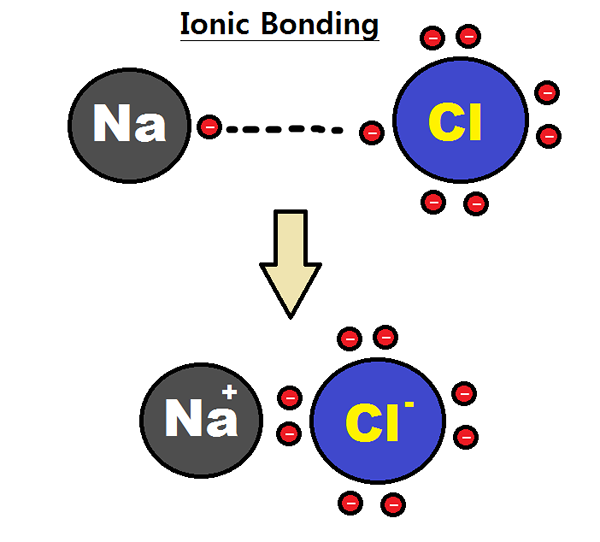
Figure 01: Formation d'une liaison ionique entre les atomes de sodium et de chlore
L'électronégativité est une mesure de l'affinité des atomes pour les électrons. Un atome, avec une électronégativité élevée peut attirer des électrons d'un atome à faible électronégativité pour former une liaison ionique. Par exemple, le chlorure de sodium a une liaison ionique entre l'ion sodium et l'ion chlorure. Le sodium est un métal et le chlore est un non-métal; Par conséquent, il a une électronégativité très faible (0.9) par rapport au chlore (3.0). En raison de cette différence d'électronégativité, le chlore peut attirer un électron de sodium et former CL-. En même temps, le sodium forme na+ ions. Pour cette raison, les deux atomes gagnent la configuration électronique de gaz noble stable. CL- et na+ sont maintenus ensemble par des forces électrostatiques attrayantes, formant ainsi une liaison ionique; Liaison na-cll.
Que sont les liaisons covalentes?
Lorsque deux atomes, ayant une différence d'électronégativité similaire ou très faible, réagissent ensemble, ils forment une liaison covalente en partageant des électrons. De cette façon, les deux atomes peuvent obtenir la configuration électronique de gaz noble en partageant des électrons. La molécule est le produit qui résulte de la formation de liaisons covalentes entre les atomes. Par exemple, les atomes du même élément se joignent pour former des molécules comme Cl2, H2, ou p4, Chaque atome se lie à un autre via une liaison covalente.
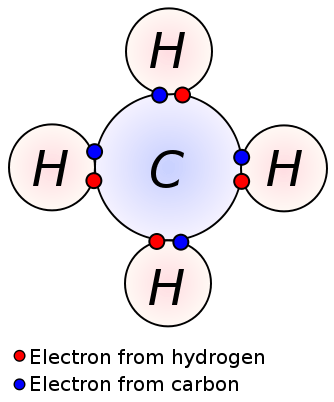
Figure 02: liaisons covalentes entre le carbone et les atomes d'hydrogène dans la molécule de méthane
Molécule de méthane (ch4) a également des liaisons covalentes entre les atomes de carbone et d'hydrogène; Il y a quatre liaisons covalentes entre un atome de carbone central et quatre atomes d'hydrogène (quatre liaisons C-H). Le méthane est un exemple de molécule ayant des liaisons covalentes entre les atomes à très faible différence d'électronégativité.
Quelle est la différence entre les liaisons ioniques et covalentes?
Ionic vs liaisons covalentes | |
| Un lien chimique entre deux atomes causés par la force électrostatique entre les ions de charge opposée dans un composé ionique. | Un lien chimique entre deux atomes ou ions où les paires d'électrons sont partagées entre elles. |
| Nombre d'atomes | |
| Se produisent entre les métaux et les non-métaux. | Se produit le plus souvent entre deux non-métaux. |
| Nombre d'électrons | |
| Un transfert complet d'électrons se produit. | Se produit lorsque deux (ou plus) éléments partagent des électrons. |
| Composés | |
| Généralement considérés comme des cristaux, dans lesquels peu d'ions chargés positivement entourent un ion chargé négativement. | Les atomes liés par des liaisons covalentes existent sous forme de molécules qui, à température ambiante, existent principalement sous forme de gaz ou de liquides. |
| Polarité | |
| Les liaisons ioniques ont une forte polarité. | Les liaisons covalentes ont une faible polarité. |
| Propriétés physiques | |
| Les composés ioniques ont des points de fusion très élevés et des points d'ébullition, par rapport aux molécules covalentes. | Les molécules covalentes ont de faibles points de fusion et des points d'ébullition par rapport aux composés ioniques. |
| Solubilité dans l'eau | |
| Dans les solvants polaires (comme l'eau), les composés ioniques dissolvent les ions de libération; De telles solutions sont capables de conduire de l'électricité. | Dans les solvants polaires, les molécules covalentes ne se dissolvent pas considérablement; Ces solutions sont donc incapables de conduire de l'électricité. |
Résumé - Ionic vs obligations covalentes
Les liaisons ioniques et covalentes sont les deux principaux types de liaisons chimiques qui existent dans les composés. La différence entre les liaisons ioniques et covalentes est que les liaisons ioniques se produisent entre les atomes ayant des électronégativités très différentes tandis que les liaisons covalentes se produisent entre les atomes avec des différences d'électronégativité similaires ou très faibles.
Référence:
1. Helmenstine, Anne Marie, Ph.D. «Définition des obligations ioniques."Thoughtco, février. 10, 2017. Disponible ici
2. Helmenstine, Anne Marie, Ph.D. «Définition des obligations covalentes."Thoughtco, février. 7, 2018. Disponible ici
Image gracieuseté:
1.'IonicBondingrh11'By Rhannosh - Propre travaux, (CC BY-SA 3.0) via Commons Wikimedia
2.«Covalent» Dynablast - Créé avec Inkscape, (CC By-SA 2.5) Via Commons Wikimedia


