Différence entre les forces dipolaires ioniques et dipolaires dipolaires

Différence clé - Dipôle ionique vs Dipol Forces dipolaires
Les forces intermoléculaires sont les forces d'attraction existent entre différentes molécules. Les forces ion-dipoles et les forces dipolaires-dipoles sont deux formes de forces intermoléculaires. Certains autres exemples de forces intermoléculaires comprennent les forces dipolaires induites par l'ion, les liaisons hydrogène et les forces de van der Waal. Ces forces sont des attractions électrostatiques car les molécules sont attirées en fonction de leurs charges électriques. Le différence clé entre les forces ion-dipole et dipol-dipole est que Des forces ion-dipôles existent entre les espèces ioniques et les molécules polaires tandis que les forces dipol-dipôles existent entre les molécules polaires.
CONTENU
1. Aperçu et différence clé
2. Quelles sont les forces dipolaires ioniques
3. Qu'est-ce que les forces dipolaires dipolaires
4. Similitudes entre les forces dipolaires dipolaires ioniques et dipolaires
5. Comparaison côte à côte - ion dipôle vs forces dipolaires dipolaires sous forme tabulaire
6. Résumé
Quelles sont les forces dipolaires ioniques?
Les forces ion-dipôles sont des forces d'attraction entre les espèces ioniques et les molécules polaires.Les espèces ioniques peuvent être un anion (une espèce chargée négativement) ou un cation (une espèce chargée positivement).Une molécule polaire est toute molécule qui a une séparation de charge électrique permanente au sein de la molécule en raison de différences entre les valeurs d'électronégativité des atomes dans cette molécule. L'électronégativité est la capacité d'attirer des électrons. Lorsqu'un atome ayant une électronégativité élevée est lié à un atome ayant une faible électronégativité, les électrons de liaison sont attirés par l'atome ayant la haute électronégativité (alors il obtient une charge négative partielle), donnant l'atome moins électronégatif une charge positive partielle. Cet état de séparation de charge est appelé polarisation et la molécule est appelée molécule polaire.
Les forces ion-dipôles sont plus fortes que les forces dipol-dipole. C'est parce que ce type de force intermoléculaire implique des espèces ioniques qui ont une charge électrique plus élevée par rapport à une molécule polaire. Les forces ion-dipoles sont encore plus fortes que la liaison hydrogène. Cette interaction se produit en raison des interactions électrostatiques entre l'ion et le dipôle.
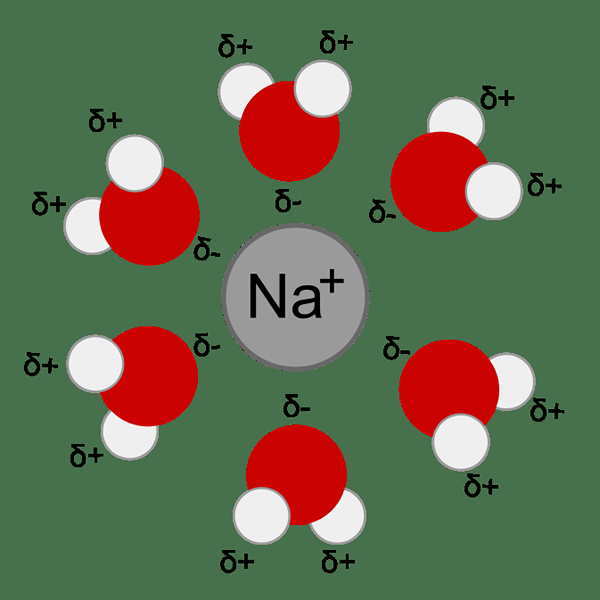
Figure 01: L'hydratation des ions métalliques se produit en raison de l'attraction entre l'ion métallique et les molécules d'eau (dipôle)
Une sous-catégorie des forces d'ion-dipole est des forces dipolaires induites par l'ion qui impliquent une molécule non polaire au lieu d'une molécule polaire. Une molécule non polaire n'a pas de dipôle (pas de séparation de charge). La charge d'ion provoque la polarisation de la molécule non polaire en déformant le nuage électronique de la molécule non polaire.
Quelles sont les forces dipolaires dipolaires?
Les forces dipolaires-dipole sont des forces intermoléculaires qui se produisent entre les molécules polaires. Ce sont des forces électrostatiques. Lors de la formation de ce type de force, les molécules polaires ont tendance à être alignées de sorte que l'attraction entre les molécules est maximisée en réduisant l'énergie potentielle. Cet alignement réduit également les répulsions entre les molécules.

Figure 02: Force d'attraction entre les molécules Polar HCL
Lorsqu'une série de composés avec des masses molaires similaires est considérée (qui ont des forces d'interaction dipol-dipole entre les molécules), la force des forces dipol-dipole augmente à mesure que la polarité augmente. Cela se produit parce que lorsque la polarité est élevée, cela signifie que la séparation des charges est élevée. Lorsque la molécule a une séparation de charge élevée (bornes hautes positives et négatives chargées élevées dans la même molécule), elle a tendance à attirer fortement les charges opposées. Cela conduit également à augmenter le point d'ébullition des composés. Les forces dipolaires dipolaires sont plus élevées, le point d'ébullition est grand.
Quelles sont les similitudes entre les forces dipolaires ioniques et dipolaires?
- Les forces dipolaires ioniques et dipolaires sont des types d'interactions intermoléculaires
- Les forces dipolaires dipolaires et dipolaires ioniques sont des forces électrostatiques
Quelle est la différence entre les forces dipolaires ioniques et dipolaires?
Ion dipôle vs forces dipolaires dipolaires | |
| Les forces dipolaires ioniques sont des forces attractives entre les espèces ioniques et les molécules polaires. | Les forces dipolaires-dipole sont des forces intermoléculaires qui se produisent entre les molécules polaires. |
| Force | |
| Les forces ion-dipôles sont plus fortes que les liaisons hydrogène et les forces dipolaires-dipoles. | Les forces dipol-dipole sont plus faibles que les liaisons hydrogène et les forces ion-dipoles. |
| Composants | |
| Les forces ion-dipôles se produisent entre les ions (cations ou anions) et les molécules polaires. | Les forces dipol-dipoles surgissent entre les molécules polaires. |
Résumé - Ion dipôle vs Dipol Forces dipolaires
Les forces ion-dipoles et les forces dipolaires-dipoles sont des forces intermoléculaires qui existent entre différentes espèces chimiques telles que les cations, les anions et les molécules polaires. Les molécules polaires sont des composés covalents ayant des dipoles (séparations de charge électrique). Une molécule polaire a un terminal chargé positivement et un terminal chargé négativement dans la même molécule. Par conséquent, ces terminaux peuvent avoir des attractions électrostatiques avec des charges opposées. La différence entre les forces ion-dipole et dipol-dipole est que les forces ion-dipoles existent entre les espèces ioniques et les molécules polaires alors que les forces dipolaires-dipolaires existent entre les molécules polaires.
Référence:
1.«11.3: Forces dipolaires-dipoles.”Chemistry LibreTexts, LibreTexts, 11 février. 2018. Disponible ici
2.Forces dipolaires-dipôles. Disponible ici
3.«Force intermoléculaire.»Wikipedia, Wikimedia Foundation, 14 mars. 2018. Disponible ici
Image gracieuseté:
1.'Na + H2O'By Taxman (domaine public) via Commons Wikimedia
2.'Dipole-dipole-interaction dans-hcl-2D'By Benjah-Bmm27 - Propre travaux, (domaine public) via Commons Wikimedia