Différence entre l'iode et l'iodure

Le différence clé entre l'iode et l'iodure L'iode est un élément chimique alors que l'iodure est un anion.
Nous pouvons comprendre très facilement la variation de l'iode et de l'iodure si l'on a une compréhension de base de la chimie. Mais, il y en a beaucoup qui se confondent avec les deux termes et utilisent les deux mots de manière interchangeable, ce qui n'est pas correct. L'iode est un composé chimique qui est de couleur violet tandis que l'iodure est un ion et ne peut rester à l'état libre que cela doit se combiner avec un autre élément ou des éléments pour former un composé. Par conséquent, l'iode est un élément avec un numéro atomique élevé 53, et nous pouvons le représenter par le symbole I alors que l'iodure est un ion et est représenté par 1-.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'iode
3. Qu'est-ce que l'iodure
4. Comparaison côte à côte - iode vs iodure sous forme tabulaire
5. Résumé
Qu'est-ce que l'iode?
L'iode est un élément chimique ayant le numéro atomique 53 et le symbole chimique I. C'est l'halogène le plus lourd (les halogènes sont des éléments chimiques du groupe 17 dans le tableau périodique). De plus, cet élément existe à l'état solide à température ambiante. Il a une apparence brillante et gris métallique. De plus, ce composé subit facilement une sublimation pour former le gaz violet de l'iode.

Figure 01: vapeur d'iode
De plus, il existe de nombreux états d'oxydation que l'iode peut exister. Cependant, l'oxydation -1 est la plus courante parmi elles, ce qui se traduit par l'anion iodure. Certains faits chimiques sur l'iode sont les suivants:
- Numéro atomique - 53
- Poids atomique standard - 126.9
- Apparence - Solide brillant métallique
- Configuration d'électrons - [KR] 4ddix 5s2 5p5
- Groupe - 17
- Période - 5
- Catégorie chimique - Non-métal
- Point de fusion - 113.7 ° C
- Point d'ébullition - 184.3 ° C
Surtout, l'iode est un fort oxydant; Cela est principalement dû au fait qu'il a un octet incomplet de configuration d'électrons dans lequel il manque un électron pour remplir l'orbital p le plus extérieur. Cependant, c'est l'agent oxydant le plus faible parmi les autres halogènes en raison de sa grande taille atomique.
Qu'est-ce que l'iodure?
L'iodure est un anion d'iode. Cet anion se forme lorsque l'atome d'iode obtient un électron de l'extérieur. En conséquence, le symbole chimique de l'iodure est i- , et la masse molaire de cet ion est 126.9 g / mol. Nous nommons les composés chimiques constitués de cet anion généralement comme des «iodures». Surtout, l'iodure est le plus grand anion monatomique car il se forme à partir de l'atome d'iode qui a comparativement une grande taille atomique. De plus, l'iodure forme des liaisons relativement faibles avec des ions opposés en raison de la même raison d'être un grand ion. De plus, pour la même raison, l'iodure est moins hydrophile que les autres petits anions.

Figure 02: L'iodure de potassium est un composé commun contenant un ion d'iodure
La plupart du temps, les composés contenant des ions d'iodure tels que le sel d'iodure sont solubles à l'eau mais moins que celui des chlorures et des bromures. En plus de cela, les solutions aqueuses contenant cet anion peuvent augmenter la solubilité des molécules d'iode (i2) mieux que celui de l'eau pure.
Quelle est la différence entre l'iode et l'iodure?
L'iode et l'iodure sont des termes étroitement liés car l'iodure est dérivé de l'iode. Par conséquent, la plupart du temps, nous utilisons ces deux termes de manière interchangeable, ce qui est faux. C'est parce que l'iode est différent de l'iodure. La principale différence entre l'iode et l'iodure est que l'iode est un élément chimique alors que l'iodure est un anion. De plus, il existe peu d'autres différences telles que le nombre d'électrons dans chaque espèce chimique, la réactivité, etc.
L'infographie ci-dessous fournit plus de faits sur la différence entre l'iode et l'iodure.
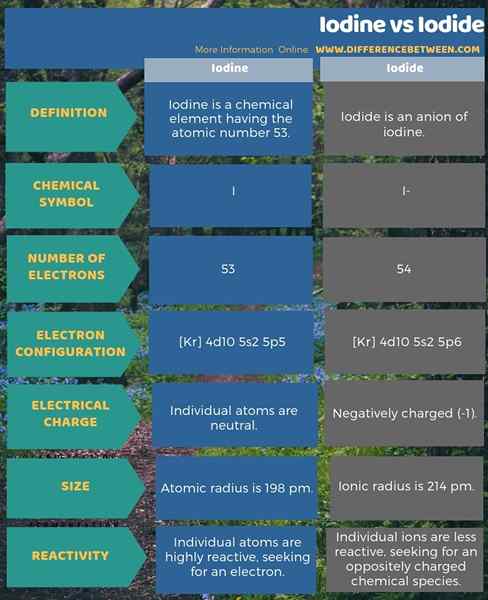
Résumé - iode vs iodure
Les termes iode et iodure semblent similaires, mais nous ne pouvons pas les utiliser de manière interchangeable parce que ce sont deux espèces chimiques différentes. La principale différence entre l'iode et l'iodure est que l'iode est un élément chimique alors que l'iodure est un anion.
Référence:
1. "Iode.»Wikipedia, Wikimedia Foundation, 17 octobre. 2018. Disponible ici
2. «Iodure.»Wikipedia, Wikimedia Foundation, 9 septembre. 2018. Disponible ici
Image gracieuseté:
1.«Iode-évaporant» von Jurii (CC par 3.0) via Commons Wikimedia
2.«Iodure de potassium» (domaine public) via Commons Wikimedia


