Différence entre la liaison hydrogène intermoléculaire et intramoléculaire
Différence clé - intermoléculaire vs liaison hydrogène intramoléculaire
La liaison hydrogène est une forme de force d'attraction entre certaines molécules polaires. C'est un type de liaison faible que les liaisons ioniques ou covalentes, mais sont de fortes forces d'attraction par rapport aux forces dipol-dipole et aux forces van der Waal. Une liaison hydrogène est formée si la molécule polaire a un atome fortement électronégatif ayant une paire d'électrons solitaires (qui peut agir comme donneur d'électrons) lié à un atome d'hydrogène (un accepteur d'électrons). Étant donné que l'atome fortement électronégatif peut attirer l'électron de liaison par elle-même que celle d'un atome d'hydrogène, l'atome d'hydrogène obtient une charge positive partielle, entraînant une forte séparation de charge. Par conséquent, les liaisons chimiques de liaison hydrogène communes sont des liaisons O-H, une liaison N-H et une liaison F-H. Il existe deux formes de liaisons hydrogène qui peuvent être formées; liaison hydrogène intermoléculaire qui se produit entre les molécules polaires et la liaison hydrogène intramoléculaire qui se produit dans la même molécule unique. Le différence clé entre la liaison hydrogène intermoléculaire et intramoléculaire est que La liaison hydrogène intermoléculaire se produit entre deux molécules tandis que la liaison hydrogène intramoléculaire se produit dans une seule molécule.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la liaison hydrogène intermoléculaire
3. Qu'est-ce que la liaison hydrogène intramoléculaire
4. Comparaison côte à côte - liaison hydrogène intramoléculaire intermoléculaire vs sous forme tabulaire
5. Résumé
Qu'est-ce que la liaison hydrogène intermoléculaire?
Des liaisons hydrogène intermoléculaires se produisent entre des molécules séparées dans une substance. Par conséquent, le donneur d'électrons et l'accepteur d'électrons devraient être présents dans deux molécules distinctes. Si des donneurs d'électrons et des accepteurs appropriés sont présents, toute molécule peut former des liaisons hydrogène.

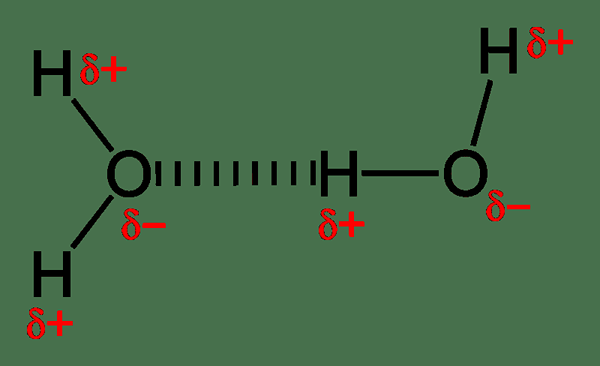
Figure 01: Liaison hydrogène intermoléculaire dans les molécules d'eau
Un exemple courant pour les molécules qui peuvent former des liaisons hydrogène intermoléculaires sont les molécules d'eau (H2O).Les liaisons hydrogène entre les molécules d'eau provoquent la formation d'une structure rigide lorsque l'eau liquide est convertie en glace solide.
Qu'est-ce que la liaison hydrogène intramoléculaire?
Les liaisons hydrogène intramoléculaires sont celles qui se produisent dans une seule molécule.Ce type de liaison hydrogène survient lorsque deux groupes fonctionnels capables de former des liaisons hydrogène entre eux sont présents dans la même molécule unique. Cela signifie que le donneur d'électrons et l'accepteur d'électrons devraient être présents dans la même molécule.
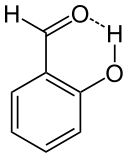
Figure 02: Liaison hydrogène intramoléculaire dans le salicylaldéhyde
De plus, ces deux groupes fonctionnels doivent être positionnés suffisamment près de cette liaison hydrogène. L'exemple le plus courant d'une molécule qui montre ce type de liaison hydrogène est le salicylaldéhyde (C7H6O2).
Quelle est la différence entre la liaison hydrogène intermoléculaire et intramoléculaire?
Intermoléculaire vs liaison hydrogène intramoléculaire | |
| Des liaisons hydrogène intermoléculaires se produisent entre des molécules séparées dans une substance. | Les liaisons hydrogène intramoléculaires sont celles qui se produisent dans une seule molécule. |
| Composants | |
| Des liaisons hydrogène intermoléculaires se forment entre deux molécules. | Des liaisons hydrogène intramoléculaires se forment entre les molécules séparées. |
Résumé - intermoléculaire vs liaison hydrogène intramoléculaire
La liaison hydrogène est une forme d'interaction dipol-dipole. Mais c'est un type de liaison faible. Il existe deux formes de liaison hydrogène comme liaisons hydrogène intermoléculaires et intramoléculaires. La différence entre la liaison hydrogène intermoléculaire et intramoléculaire est que la liaison hydrogène intermoléculaire se produit entre deux molécules tandis que la liaison hydrogène intramoléculaire se produit dans une seule molécule.
Référence:
1.«Liaison hydrogène.”Chemistry LibreTexts, LibreTexts, 21 juillet 2016. Disponible ici
2."Liaison hydrogène.»Wikipedia, Wikimedia Foundation, 14 mars. 2018. Disponible ici
Image gracieuseté:
1.'Hydrogène-liaison dans l'eau-2D' (domaine public) via Commons Wikimedia
2.'Salicylaldéhyd Wasserstoffbrücke'by neurotiker ⇌ - propre travail, (domaine public) via Commons Wikimedia


