Différence entre le droit du gaz idéal et le droit réel du gaz
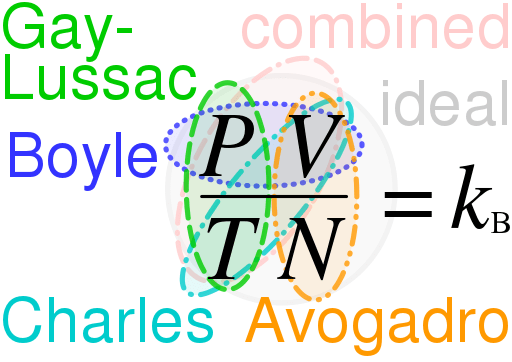
Le différence clé entre le droit idéal du gaz et le droit réel du gaz est que La loi idéale sur le gaz décrit le comportement d'un gaz théorique, tandis que le droit réel du gaz décrit le comportement des gaz qui se produisent réellement dans l'univers.
Un gaz idéal est un gaz théorique dont les particules de gaz en mouvement aléatoire ont des collisions complètement élastiques et aucune autre interaction entre elles. Selon cette définition, nous pouvons comprendre que ces gaz idéaux ne peuvent pas se produire dans la nature car il existe essentiellement des interactions entre les particules de gaz pour tout gaz que nous connaissons. En fait, les gaz que nous connaissons sont des gaz réels.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la loi sur le gaz idéal
3. Qu'est-ce que le vrai droit du gaz
4. Comparaison côte à côte - loi sur le gaz idéal vs droit réel du gaz sous forme tabulaire
5. Résumé
Quelle est la loi sur le gaz idéal?
La loi idéale sur le gaz est une équation qui décrit le comportement d'un gaz idéal. Les gaz idéaux sont hypothétiques, et ces gaz ne se produisent que dans les théories. Par conséquent, en utilisant la loi idéale sur le gaz, nous pouvons comprendre et estimer le comportement de nombreux gaz réels que nous connaissons. Cependant, il a plusieurs limites. De plus, cette loi est une combinaison de plusieurs autres lois:
- la loi de Boyle
- La loi de Charles
- La loi d'Avogadro
- Loi de Gay-Lussac
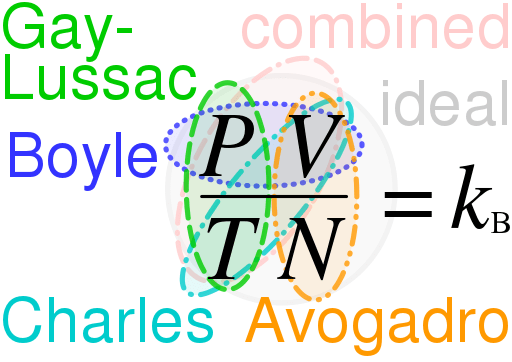
Calcul
Fondamentalement, nous pouvons donner la loi idéale sur le gaz comme suit;
PV = NRT
Où, p est la pression, v est le volume et t est la température du gaz idéal. Ici, «n» est le nombre de moles du gaz idéal et «R» est une constante - nous l'appelons constante de gaz idéale. Il a une valeur universelle; La valeur de r est la même pour n'importe quel gaz, et elle est 8.314 J / (k · mol).
De plus, nous pouvons obtenir différents dérivés de cette loi; forme molaire, forme combinée, etc. Par exemple, comme «N» est le nombre de moles, nous pouvons le donner en utilisant le poids moléculaire du gaz. La dérivation est la suivante.
n = m / m
où, n est le nombre de moles de gaz, m est la masse du gaz et m est le poids moléculaire du gaz. En utilisant l'équation ci-dessus,
PV = NRT
Pv = (m / m) rt
Si nous voulons obtenir la densité du gaz, nous pouvons utiliser l'équation ci-dessus comme suit;
P = (m / vm) rt
P = ρrt / m
De plus, si nous voulons obtenir la loi combinée au gaz de la loi idéale sur le gaz, nous pouvons le dériver comme suit; Pour deux gaz «1» et «2», la pression, le volume et la température sont P1,V1,T1 et P2, V2 et T2. Ensuite, pour les deux gaz, nous pouvons écrire deux équations comme;
P1V1 = NRT1… (1)
P2V2 = NRT2 … (2)
En divisant l'équation (1) de l'équation (2), nous obtenons,
(P1V1) / (P2V2) = T1/ T2
Nous pouvons réorganiser cette équation comme suit;
P1V1/ T1 = P2V2/ T2
Qu'est-ce que le vrai droit du gaz?
Réel droit du gaz, également appelé Van der Waals Law, est dérivé de la loi sur le gaz idéal pour décrire le comportement des gaz réels. Étant donné que les gaz réels ne peuvent pas se comporter idéalement, la loi réelle du gaz a apporté des modifications aux composants de pression et de volume dans la loi sur le gaz idéal. Ainsi, nous pouvons obtenir le volume et la pression comme suit:
Volume de gaz réel = (Vm - b)
Pression du gaz réel = (p + a n2/ V2)
Ensuite, nous pouvons obtenir le droit réel du gaz en appliquant ces composants modifiés à la loi idéale sur le gaz comme suit:
(P + a n2/ V2) (Vm - b) = nrt
Où, Vm est le volume molaire de gaz, R est constant à gaz universel, t est la température du gaz réel, p est la pression.
Quelle est la différence entre le droit idéal du gaz et le droit réel du gaz?
La loi idéale sur le gaz est une équation qui décrit le comportement d'un gaz idéal. Le droit du gaz réel est dérivé de la loi idéale sur le gaz pour convenir au comportement des gaz réels. Ainsi, la principale différence entre la loi idéale sur le gaz et le droit réel du gaz est que la loi idéale sur le gaz décrit le comportement d'un gaz théorique, tandis que le droit réel du gaz décrit le comportement des gaz qui se produisent réellement dans l'univers.
De plus, nous pouvons dériver la loi sur le gaz idéal de l'équation PV = NRT, et la loi réelle du gaz de l'équation (P + A n2/ V2) (Vm - b) = nrt.
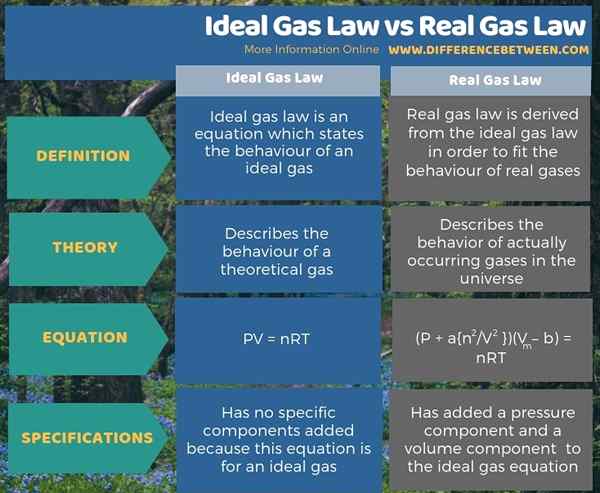
Résumé - Loi sur le gaz idéal vs droit du gaz réel
En bref, un gaz idéal est une substance hypothétique qui a des collisions complètement élastiques entre les particules de gaz, une propriété que la plupart des gaz réels que nous connaissons ne montrent pas. La principale différence entre la loi idéale sur le gaz et le droit réel du gaz est que la loi idéale sur le gaz décrit le comportement d'un gaz théorique, tandis que le droit réel du gaz décrit le comportement des gaz réellement survenus dans l'univers.
Référence:
1. Droit idéal du gaz, hyperphysique. Georgia State University, disponible ici.
Image gracieuseté:
1. «Relations idéales de droit du gaz» par CMGLEE - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia
2. «Ideal Gas Law» par Blyumj - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia


