Différence entre l'hyperconjugaison et la résonance
Différence clé - Hyperconjugation vs Resonance
L'hyperconjugaison et la résonance peuvent stabiliser les molécules ou les ions polyatomiques de deux manières différentes. Les exigences de ces deux processus sont différentes. Si une molécule peut avoir plus d'une structure de résonance, cette molécule possède la stabilisation de résonance. Mais, l'hyperconjugaison se produit en présence d'une liaison σ avec un p-orbital vide ou partiellement rempli d'orbital ou un π-orbital. C'est le différence clé Hyperconjugaison et résonance
Qu'est-ce que l'hyperconjugaison?
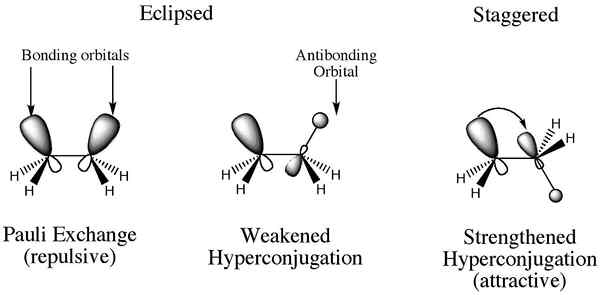
L'interaction d'électrons dans une liaison σ (généralement des liaisons C-H ou C-C) avec un p-orbital p vide ou partiellement rempli adjacent ou un π-orbital dans une orbitale moléculaire étendue en augmentant la stabilité du système. Cette interaction de stabilisation est appelée «hyperconjugation. Selon la théorie des liaisons de valence, cette interaction est décrite comme «double liaison sans résonance de liaison».

Hyperconjugation Schreiner
Qu'est-ce que la résonance?
La résonance est la méthode de décrire des électrons délocalisés dans une molécule ou un ion polyatomique lorsqu'il peut avoir plus d'une structure Lewis pour exprimer le motif de liaison. Plusieurs structures contributives peuvent être utilisées pour représenter ces électrons délocalisés dans une molécule ou un ion, et ces structures sont appelées structures de résonance. Toutes les structures contributives peuvent être illustrées à l'aide d'une structure Lewis avec un nombre dénombrable de liaisons covalentes en distribuant la paire d'électrons entre deux atomes dans la liaison. Puisque plusieurs structures Lewis peuvent être utilisées pour représenter la structure moléculaire. La structure moléculaire réelle est un intermédiaire de toutes ces structures Lewis possibles. Il s'appelle un hybride de résonance. Toutes les structures contributives ont les noyaux dans la même position, mais la distribution des électrons peut être différente.
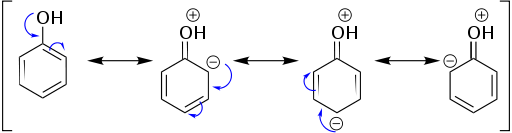
Résonance du phénol
Quelle est la différence entre l'hyperconjugaison et la résonance?
Caractéristiques de l'hyperconjugaison et de la résonance
Hyperconjugaison
- L'hyperconjugation affecte la longueur des liaisons, et elle entraîne le raccourcissement des liaisons Sigma (liaisons σ).
| Molécule | Longueur de liaison C-C | Raison |
| 1,3-butadiène | 1.46 A | Conjugaison normale entre deux parties alcényliques. |
| Méthylacétylène | 1.46 A | Hyperconjugation entre les pièces alkyle et alcynyle |
| Méthane | 1.54 A | C'est un hydrocarbure saturé sans hyperconjugaison |
- Les molécules avec hyperconjugaison ont des valeurs plus élevées pour la chaleur de formation par rapport à la somme de leurs énergies de liaison. Mais, la chaleur de l'hydrogénation par double liaison est inférieure à celle de l'éthylène.
- La stabilité des carbocations varie en fonction du nombre d'obligations C-H attachées à l'atome de carbone chargé positivement. La stabilisation d'hyperconjugaison est plus élevée lorsque de nombreuses liaisons C-H sont attachées.
(Ch3)3C+ > (Ch3)2Ch+ > (Ch3) Ch2+ > Ch3+
- La résistance à l'hyperconjugaison relative dépend du type isotopique de l'hydrogène. L'hydrogène a une plus grande résistance par rapport au deutérium (D) et au tritium (T). Tritium a le moins de capacité à montrer une hyperconjugaison parmi eux. L'énergie requise pour briser la liaison C-T> Bond C-D> Bond C-H, ce qui facilite l'hyperconjugaison de H.
Résonance
- Plusieurs structures Lewis peuvent être utilisées pour représenter la structure, mais la structure réelle est un intermédiaire de ces structures contributives, et elle est représentée par un hybride de résonance.
- Les structures de résonance ne sont pas des isomères. Ces structures de résonance ne diffèrent que par la position des électrons, mais pas dans la position des noyaux.
- Chaque structure Lewis a un nombre égal d'électrons de valence et non appariés, ce qui conduit à avoir la même charge dans chaque structure.
- La structure réelle possède une énergie potentielle totale plus faible par rapport à la valeur estimée des structures contributives. Par conséquent, les molécules / ions ayant un hybride de résonance fournissent une stabilisation supplémentaire à la molécule / ion respective.


