Différence entre le bromure d'hydrogène et l'acide hydrobromique
Le différence clé entre le bromure d'hydrogène et l'acide hydrobromique est que Le bromure d'hydrogène est une molécule ayant un atome d'hydrogène lié à un atome de brome par une liaison chimique covalente tandis que l'acide hydrobromique est un acide fort formé à partir de la dissolution du bromure d'hydrogène dans l'eau.
Le bromure d'hydrogène est un simple composé inorganique. Il contient un atome d'hydrogène ayant une seule liaison covalente avec un atome de brome. Lorsque cette substance est dissoute dans l'eau, elle forme de l'acide hydrobromique.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le bromure d'hydrogène
3. Qu'est-ce que l'acide hydrobromique
4. Comparaison côte à côte - bromure d'hydrogène vs acide hydrobromique sous forme tabulaire
5. Résumé
Qu'est-ce que le bromure d'hydrogène?
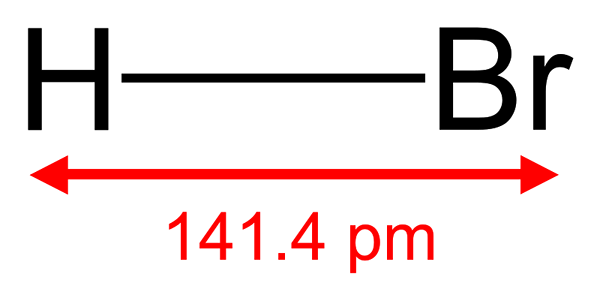
Le bromure d'hydrogène est un composé inorganique ayant la formule chimique HBR. C'est un composé moléculaire diatomique, et nous pouvons le classer comme un halogénure d'hydrogène. Dans sa forme pure, le bromure d'hydrogène est un gaz incolore et a une odeur âcre. De plus, HBR est soluble dans l'eau, l'alcool et certains autres solvants biologiques.

Figure 01: Structure de la molécule de bromure d'hydrogène
Cette substance est très soluble dans l'eau. Il peut former de l'acide hydrobromique lorsqu'il est dissous dans l'eau et saturé à environ 68.85%. La forme anhydre et la forme aqueuse de bromure d'hydrogène sont des réactifs importants dans la préparation des composés de bromure.
Le bromure d'hydrogène est important pour produire des composés de brome inorganiques et organiques. De plus, l'ajout de radicaux libres de HBR aux alcènes donne des bromures alkyle. Ces agents alkylants sont des précurseurs importants pour les dérivés d'amine gras.
Nous pouvons préparer du bromure d'hydrogène industriellement en combinant l'hydrogène et le brome à des températures entre 200 et 400 degrés Celsius. En règle générale, cette réaction est catalysée par le platine ou l'amiante. En dehors de cela, la synthèse de laboratoire du bromure d'hydrogène se fait principalement par la distillation d'une solution de bromure de sodium ou de bromure de potassium avec de l'acide phosphorique ou de l'acide sulfurique.
Lorsque l'on considère l'innocuité concernant le bromure d'hydrogène, il est hautement corrosif et irritant à l'inhalation; Ainsi, nous devons gérer soigneusement cette substance.
Qu'est-ce que l'acide hydrobromique?
L'acide hydrobromique est un acide fort préparé en dissolvant le bromure d'hydrogène dans l'eau. C'est un acide plus fort que l'acide chlorhydrique mais moins acide que l'acide hydroiodique. Cependant, c'est l'un des acides minéraux les plus forts connus. Cet acide apparaît comme un liquide jaune incolore / léger, et il a une odeur âcre.

Figure 02: Aspect de l'acide hydrobromique
L'acide hydrobromique a de nombreuses utilisations, notamment l'utilisation de cet acide dans la production de bromures inorganiques, en particulier les bromures du zinc, du calcium et du sodium. De plus, il s'agit d'un réactif utile pour générer des composés organobromine. L'acide hydrobromique peut catalyser les réactions d'alkylation et l'extraction de certains minerais.
Lorsque vous envisagez la synthèse de l'acide hydrobromique, il peut être préparé en laboratoire via la réaction entre BR2, SO2 et Water. Cette réaction donne de l'acide hydrobromique et de l'acide sulfurique comme sous-produit. Cependant, la méthode de production de laboratoire typique est la production de HBR anhydre, qui est ensuite dissous dans l'eau.
Quelle est la différence entre le bromure d'hydrogène et l'acide hydrobromique?
L'acide hydrobromique est la forme aqueuse de substance à bromure d'hydrogène. La principale différence entre le bromure d'hydrogène et l'acide hydrobromique est que le bromure d'hydrogène est une molécule ayant un atome d'hydrogène lié à un atome de brome par une liaison chimique covalente tandis que l'acide hydrobromique est un acide fort formé à partir de la dissolution du bromure d'hydrogène dans l'eau.
Ci-dessous les tables infographiques plus de différences entre le bromure d'hydrogène et l'acide hydrobromique.

Résumé - Bromure d'hydrogène vs acide hydrobromique
L'acide hydrobromique est la forme aqueuse de substance à bromure d'hydrogène. La principale différence entre le bromure d'hydrogène et l'acide hydrobromique est que le bromure d'hydrogène est une molécule ayant un atome d'hydrogène lié à un atome de brome par une liaison chimique covalente tandis que l'acide hydrobromique est un acide fort formé à partir de la dissolution du bromure d'hydrogène dans l'eau.
Référence:
1. «Bromure d'hydrogène». Science Direct, disponible ici.
Image gracieuseté:
1. «Hydrogène-Bromide-2D-Dimensions» par KES47 - (Domaine public) via Commons Wikimedia
2. «Acid hydrobromique» par MDAXO - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia


