Différence entre les complexes à rotation élevée et à faible rotation
Le différence clé Entre les complexes à rotation élevée et à faible spin est que Les complexes à rotation élevé contiennent des électrons non appariés, tandis que les complexes à rotation faible ont tendance à contenir des électrons appariés.
Les termes High Spin et Low Spin sont liés aux complexes de coordination. Ceux-ci sont appelés états de spin de complexes. Nous pouvons déterminer ces états en utilisant la théorie du champ cristallin et la théorie des champs de ligands. Généralement, les complexes octaédriques et les complexes tétraédriques sont un rotation élevée, tandis que les complexes planaires carrés sont à faible rot.
CONTENU
1. Aperçu et différence clé
2. Que sont les complexes de spin élevés
3. Que sont les complexes à faible spin
4. Comparaison côte à côte - complexes à rotation élevée vs à faible spin sous forme tabulaire
5. Résumé
Que sont les complexes de spin élevés?
Les complexes à rotation élevés sont des complexes de coordination contenant des électrons non appariés à des niveaux d'énergie élevés. Puisqu'ils contiennent des électrons non appariés, ces complexes de spin élevés sont des complexes paramagnétiques. Cela signifie que ces complexes peuvent être attirés par un champ magnétique externe.
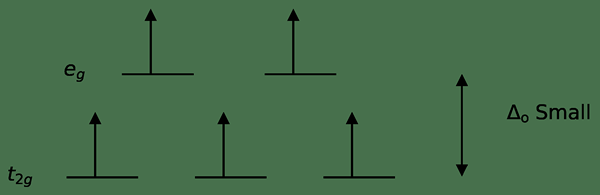
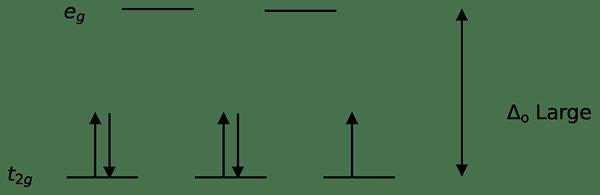
Figure 01: Diagramme de division d'énergie pour les complexes de spin élevés
Un fractionnement d'énergie à forte rotation d'un composé se produit lorsque l'énergie nécessaire pour coupler deux électrons est supérieure à l'énergie nécessaire pour placer un électron dans un état d'énergie élevé. Habituellement, les complexes de coordination octaédriques et tétraédriques sont des complexes de spin élevés.
Que sont les complexes à faible spin?
Les complexes à faible spin sont des complexes de coordination contenant des électrons appariés à de faibles niveaux d'énergie. Puisqu'il n'y a pas d'électrons non appariés dans les complexes à faible spin (tous les électrons sont appariés), ils sont diamagnétiques. Cela signifie que ces composés ne peuvent pas être attirés par un champ magnétique externe. Le fractionnement à faible énergie d'un composé se produit lorsque l'énergie nécessaire pour coupler deux électrons est inférieure à l'énergie nécessaire pour placer un électron dans un état de faible énergie. Habituellement, les complexes de coordination planaire carrés sont des complexes à faible spin.

Figure 02: Diagramme de division d'énergie pour les complexes à faible spin
Afin de déterminer si un complexe de coordination donné est un complexe de spin élevé ou un complexe à faible spin, nous pouvons utiliser les conseils suivants.
- Détermination de la forme du complexe
- Détermination de l'état d'oxydation du centre métallique
- Détermination de la configuration d'électrons D du métal
- Détermination du diagramme de champ cristallin du complexe en ce qui concerne sa géométrie
- Déterminer si l'énergie de fractionnement est supérieure à l'énergie de l'appariement
Quelle est la différence entre les complexes à rotation élevée et à faible rotation?
La principale différence entre les complexes à rotation élevée et à faible rot. Dans les complexes à rotation élevés, l'énergie nécessaire pour associer deux électrons est supérieure à l'énergie nécessaire pour placer un électron de ce complexe à un niveau d'énergie élevé. En revanche, dans les complexes à faible spin, l'énergie nécessaire pour coupler deux électrons est inférieure à l'énergie nécessaire pour placer un électron à un niveau d'énergie élevé.
De plus, une autre différence significative entre les complexes à rotation élevée et à faible rot. Généralement, les composés tétraédriques et octaédriques sont élevés tandis que les composés planaires carrés sont à faible rot.

Résumé - Complexes à rotation élevée vs à faible spin
Il existe deux types d'états de spin de complexes de coordination. Ce sont l'état de spin élevé et l'état de spin faible. La principale différence entre les complexes à rotation élevée et à faible rot.
Référence:
1. «Spin élevé et complexes à faible rotation.”Chemistry LibreTexts, LibreTexts, 21 novembre. 2019, disponible ici.
2. «États de spin (électrons D).»Wikipedia, Wikimedia Foundation, 18 novembre. 2019, disponible ici.
3. «High-spin-bas-bas-complexes.»Guru de la chimie, disponible ici.
Image gracieuseté:
1. «Diagramme de division de spin CFT-High-Vector» par Offnfopt, image de référence créée par Yana - Propre travaux créés à l'aide de fichier: CFT - Schéma de fractionnement de spin élevé 2.PNG comme référence (CC0) via Commons Wikimedia
2. «Vector-vecteur de division CFT-Low Spin» par Offnfopt, image de référence créée par Yana - Propre travaux créés à l'aide de fichier: CFT - Schéma de fractionnement bas bas 2.PNG comme référence (domaine public) via Commons Wikimedia


