Différence entre la loi de Graham sur l'épanchement et la diffusion
Le différence clé Entre la loi de Graham sur l'épanchement et la diffusion La loi sur l'épanchement de Graham est appliquée à un gaz qui passe par une ouverture plus petite que les particules de gaz tandis que la loi de diffusion de Graham est appliquée aux molécules de gaz qui se dispersent dans un récipient.
La loi de Graham stipule que le taux de diffusion ou d'épanchement d'un gaz est inversement proportionnel à la racine carrée de sa masse molaire. Cette loi a été développée par le chimiste physique Thomas Graham en 1848.
CONTENU
1. Aperçu et différence clé
2. Quelle est la loi de l'épanchement de Graham
3. Quelle est la loi de diffusion de Graham
5. Comparaison côte à côte - Loi de Graham sur l'épanchement et la diffusion sous forme tabulaire
6. Résumé
Quelle est la loi de l'épanchement de Graham?
La loi sur l'épanchement de Graham indique que le taux de diffusion ou d'épanchement d'un gaz est inversement proportionnel à la racine carrée de sa masse molaire. Nous pouvons donner cette loi comme une expression mathématique comme suit;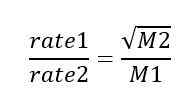
Dans cette expression mathématique, Rate1 est le taux d'épanchement d'un gaz; Le taux2 est le taux d'épanchement pour un deuxième gaz; M1 est la masse molaire du premier gaz tandis que M2 est la masse molaire du deuxième gaz. Selon cette relation, si la masse molaire d'un gaz est quatre fois la masse molaire d'un autre gaz, elle diffuse à travers un bouchon poreux à la moitié du taux de l'autre gaz. La loi de Graham est la base de la séparation des isotopes par diffusion (important dans la production de la bombe atomique).
Pour l'épanchement moléculaire de gaz qui implique le mouvement d'un gaz à la fois à travers un trou, la loi de Graham est la théorie la plus précise pour le calcul du taux de fuite de gaz. Cependant, il n'est qu'environ précis pour la diffusion d'un gaz dans un autre gaz car il inclut le mouvement d'un gaz dans un autre gaz.
Quelle est la loi de diffusion de Graham?
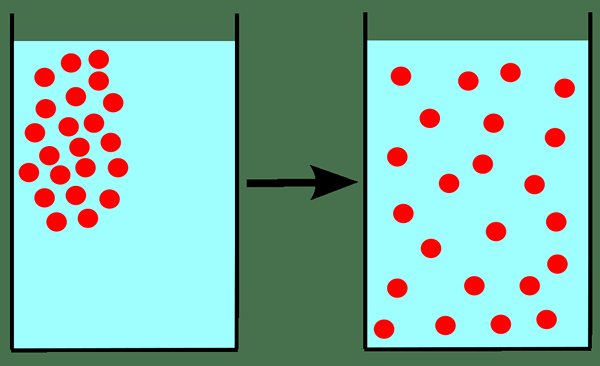
La loi de diffusion de Graham est une loi en chimie qui indique que le taux de diffusion ou d'épanchement d'un gaz est inversement proportionnel à la racine carrée de sa masse molaire. Lorsque nous appliquons cette loi pour la diffusion d'un gaz, nous devons d'abord savoir ce qu'est la diffusion. La diffusion fait référence au mélange progressif des gaz en raison du mouvement des particules de gaz en l'absence d'agitation mécanique comme l'agitation.

Figure 01: Diffusion
Cette loi n'est qu'approximativement précise pour la diffusion d'un gaz dans un autre gaz (car elle inclut le mouvement d'un gaz dans un autre gaz).
Quelle est la différence entre la loi de Graham sur l'épanchement et la diffusion?
La loi de Graham stipule que le taux de diffusion ou d'épanchement d'un gaz est inversement proportionnel à la racine carrée de sa masse molaire. La principale différence entre la loi de Graham sur le épanchement et la diffusion est que la loi d'épanchement de Graham est appliquée pour un gaz qui passe par une ouverture plus petite que les particules de gaz tandis que la loi de diffusion de Graham est appliquée aux molécules de gaz qui se dispersent dans tout un récipient de Graham. Par ailleurs, la loi de Graham sur l'épanchement est la loi la plus précise pour l'épanchement tandis que la loi de diffusion de Graham n'est que approximativement précise pour la diffusion.
L'infographie ci-dessous résume la différence entre la loi de Graham sur le épanchement et la diffusion.

Résumé - Loi de Graham sur l'épanchement vs diffusion
La loi de Graham stipule que le taux de diffusion ou d'épanchement d'un gaz est inversement proportionnel à la racine carrée de sa masse molaire. La principale différence entre la loi de Graham sur le épanchement et la diffusion est que la loi d'épanchement de Graham est appliquée pour un gaz qui passe par une ouverture plus petite que les particules de gaz tandis que la loi de diffusion de Graham est appliquée aux molécules de gaz qui se dispersent dans tout un récipient de Graham.
Référence:
1. «2.9: Graham's Lois de diffusion et d'épanchement." Chemistry LibreTexts, LibreTexts, 14 juillet 2020, disponible ici.
Image gracieuseté:
1. «Diffusion» par JRPOL - propre travail (CC par 3.0) via Commons Wikimedia


