Différence entre la cellule galvanique et les cellules de concentration
Le différence clé entre la cellule galvanique et la cellule de concentration est que un La cellule galvanique peut ou non avoir les deux demi-cellules avec la même composition alors qu'une cellule de concentration a deux demi-cellules avec la même composition.
La cellule galvanique et la cellule de concentration sont des cellules électrochimiques. Une cellule électrochimique est un appareil qui peut produire de l'électricité en utilisant une réaction chimique ou faire une réaction chimique en utilisant l'électricité.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la cellule galvanique
3. Qu'est-ce que la cellule de concentration
4. Comparaison côte à côte - cellule galvanique vs cellule de concentration sous forme tabulaire
5. Résumé
Qu'est-ce qu'une cellule galvanique?
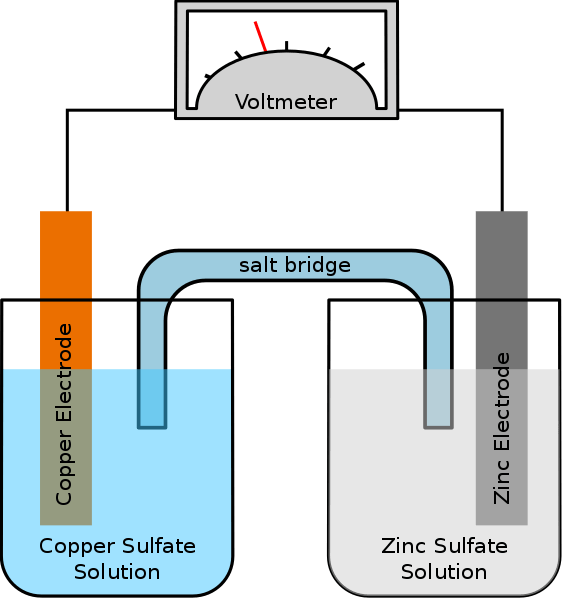
Une cellule galvanique est un type de cellule électrochimique qui utilise des réactions redox spontanées pour générer de l'énergie électrique. Un synonyme de cette cellule est une cellule voltaïque. La cellule contient deux demi-cellules qui peuvent être soit de la même composition ou de compositions différentes. Chaque demi-cellule contient une électrode et un électrolyte. L'électrode doit être immergée dans la solution électrolytique. Parfois, ces électrolytes sont complètement séparés, mais d'autres fois, ils ne sont séparés que par une barrière poreuse. Lorsque les électrolytes sont complètement séparés, nous devons utiliser un pont de sel pour maintenir le mouvement des ions entre les deux électrolytes.

Figure 01: Cellule galvanique simple
Lors de la préparation de cette cellule, nous devons déterminer si les électrodes et les électrolytes sont spontanés ou non. Nous pouvons le trouver théoriquement en calculant les potentiels d'électrode de chaque demi-cellule. Cependant, la demi-cellule devrait montrer de l'oxydation, tandis que l'autre demi-cellule devrait montrer une réaction de réduction. L'oxydation se produit à l'anode, tandis que la réduction se produit à la cathode. Puisqu'une cellule galvanique (voltaïque) utilise l'énergie libérée lors d'une réaction redox spontanée pour produire de l'électricité, les cellules galvaniques sont importantes comme source d'énergie électrique. Ils produisent un courant direct.
Qu'est-ce qu'une cellule de concentration?
La cellule de concentration est un type de cellule galvanique dans laquelle les deux demi-cellules de la cellule sont similaires en composition. Par conséquent, nous disons que les deux demi-cellules sont équivalentes. Ils ne diffèrent que par la concentration. La tension produite par cette cellule est très petite car cette cellule a tendance à obtenir un état d'équilibre. L'équilibre vient lorsque les concentrations des deux demi-cellules deviennent égales.
La cellule de concentration produit de l'électricité par réduction de l'énergie libre thermodynamique du système. Étant donné que la composition des demi-cellules est similaire, la même réaction se produit, mais dans des directions opposées. Ce processus augmente la concentration de la cellule de concentration plus faible et diminue la concentration de la cellule de concentration plus élevée. Au fur et à mesure que l'électricité circule, l'énergie thermique est générée. La cellule absorbe cette énergie comme chaleur. Il existe deux types de cellules de concentration comme suit:
- Cellule de concentration d'électrolyte - Les électrodes sont constituées de la même substance, et les demi-cellules contiennent le même électrolyte avec différentes concentrations
- Cellule de concentration d'électrode - Deux électrodes (de la même substance) de différentes concentrations sont trempées dans le même électrolyte
Quelle est la différence entre les cellules galvaniques et les cellules de concentration?
Une cellule galvanique est un type de cellule électrochimique qui utilise des réactions redox spontanées pour générer de l'énergie électrique. Une cellule de concentration, en revanche, est un type de cellule galvanique dans laquelle les deux demi-cellules de la cellule sont similaires en composition. Par conséquent, la principale différence entre la cellule galvanique et la cellule de concentration est que la cellule galvanique peut ou non avoir les deux demi-cellules avec la même composition tandis que la cellule de concentration a deux demi-cellules avec la même composition.
De plus, les électrodes de cellule galvanique peuvent être faites de la même substance ou des substances différentes tandis que les électrodes de cellule de concentration sont faites de la même substance avec la même concentration ou des concentrations différentes. En plus de ceux-ci, les cellules galvaniques ont le même électrolyte ou des électrolytes différents dans deux demi-cellules tandis que les cellules de concentration ont le même électrolyte avec la même concentration ou des concentrations différentes.
L'infographie ci-dessous résume la différence entre les cellules galvaniques et les cellules de concentration.

Résumé - cellule galvanique vs cellule de concentration
Une cellule galvanique est un type de cellule électrochimique qui utilise des réactions redox spontanées pour générer de l'énergie électrique. La cellule de concentration est un type de cellule galvanique dans laquelle les deux demi-cellules de la cellule sont similaires en composition. Par conséquent, la principale différence entre la cellule galvanique et la cellule de concentration est que la cellule galvanique peut ou non avoir les deux demi-cellules avec la même composition tandis que la cellule de concentration a deux demi-cellules avec la même composition.
Référence:
1. Helmenstine, Anne Marie. «Cellules électrochimiques."Thoughtco, Jan. 26, 2019, disponible ici.
Image gracieuseté:
1. «Galvanic Cell» par Gringer - Fichier: Galvanische Zelle.png, par tinux (cc by-sa 3.0) via Commons Wikimedia


