Différence entre la masse de l'unité de formule et la masse moléculaire
Différence clé - Formule Masse unitaire vs masse moléculaire
Formule unité de masse ou formule masse d'un composé est la masse de formule empirique de ce composé. La formule empirique d'un composé est la formule chimique qui donne le rapport entre différents atomes présents dans ce composé en petits nombres entiers. En d'autres termes, c'est le moindre rapport entre les éléments chimiques dans un composé. Il ne donne pas le nombre réel de chaque élément chimique. Lorsque la masse de cette formule est mesurée, elle est connue sous le nom de masse de l'unité de formule. La masse moléculaire d'un composé est la masse d'une molécule d'une substance particulière. La plupart du temps, les termes masse molaire et masse moléculaire sont utilisés de manière interchangeable, bien que ce soient des termes distincts. La masse molaire est la masse d'une taupe de substance tandis que la masse moléculaire n'est pas la masse d'une taupe d'une substance. Pour les molécules simples, la masse de la formule et la masse moléculaire sont les mêmes. Mais pour les composés complexes, il y a une grande différence entre deux valeurs. Le différence clé entre la masse de l'unité de formule et la masse moléculaire est que La valeur de la masse de l'unité de formule est toujours plus petite ou similaire à la masse moléculaire de la même substance alors que la valeur de la masse moléculaire est toujours plus grande ou similaire à la masse de l'unité de formule de la même substance.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la masse de l'unité de formule
3. Qu'est-ce que la masse moléculaire
4. Similitudes entre la masse de l'unité de formule et la masse moléculaire
5. Comparaison côte à côte - Masse de l'unité de formule vs masse moléculaire sous forme tabulaire
6. Résumé
Qu'est-ce que la masse de l'unité de formule?
Masse ou formule de la formule est la masse de la formule empirique d'une substance particulière. Cela signifie que c'est la somme des masses atomiques des éléments chimiques présents dans la formule empirique. La formule empirique est la formule chimique d'une substance qui donne le rapport le plus simple entre les éléments chimiques présents dans une substance. Par exemple, la formule empirique pour C6H12O6 (glucose) est ch2O. Considérons quelques exemples pour comprendre le concept.
Calcul de la masse de l'unité de formule
Formule Unit Mass de composés simples
Pour des composés simples tels que le NaCl (chlorure de sodium), la formule empirique et la formule moléculaire sont les mêmes. La valeur de la masse de l'unité de formule est,
(Masse atomique de Na) + (masse atomique de Cl) = (23 + 35.5) AMU = 58.5 amu
Formule unité de masse de composés complexes
Pour des composés complexes tels que c11H22O11 (saccharose), la formule empirique est ch2 Ensuite, la masse de l'unité de formule est,
(Masse atomique de c) + 2 (masse atomique de h) + (masse atomique de o) = (12 + 2 × 1 + 16) Amu = 30 amu.
Pour les composés en polymère, la masse de l'unité de formule est la masse d'une unité de répétition. Un polymère est une macromolécule qui est fabriquée à partir de nombreux nombres de petits composés appelés monomères. Une unité de répétition représente le monomère ou les monomères utilisés pour produire le composé polymère. Par conséquent, il équivaut à la formule empirique d'un composé complexe.
Qu'est-ce que la masse moléculaire?
La masse moléculaire est la masse d'une molécule d'une substance particulière. Il est également connu sous le nom de poids moléculaire. Le poids moléculaire est calculé comme la somme de la masse atomique de tous les éléments chimiques présents dans la molécule compte tenu des rapports réels entre ces éléments.
Par conséquent, pour les grands composés complexes, la valeur de la masse de l'unité de formule est toujours plus grande que celle de la masse moléculaire. Mais pour les petites molécules simples, les deux peuvent être les mêmes.
Calcul de la masse moléculaire
Considérons quelques exemples pour comprendre la méthode de calcul.
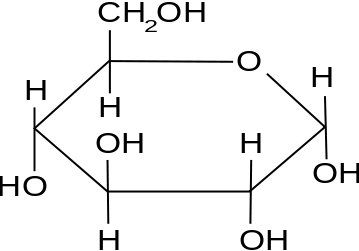
Exemple: glucose
La formule chimique du glucose est C6H12O6. Par conséquent, le poids moléculaire du glucose est,
6 (masse atomique de c) + 12 (masse atomique de H) + 6 (masse atomique de O)
= 6 (12 amu) + 12 (1 amu) + 6 (16 amu)
= (72 + 12 + 96) AMU
= 180 amu.

Figure 01: molécule de glucose
Exemple: carbonate de calcium
La formule chimique du carbonate de calcium est le caco3 , qui est aussi la formule empirique de ce composé. Par conséquent, le poids moléculaire du carbonate de calcium est,
(Masse atomique de Ca) + (masse atomique de c) + 3 (masse atomique de O)
= (40 + 12 + 3 x 16) AMU
= 100 amu
Quelles sont les similitudes entre la masse de l'unité de formule et la masse moléculaire?
- La masse de l'unité de formule et la masse moléculaire sont des mesures de poids des substances.
- La masse de l'unité de formule et la masse moléculaire ont la même unité de mesure.
Quelle est la différence entre la masse de l'unité de formule et la masse moléculaire?
Formule unité de masse vs masse moléculaire | |
| Masse ou formule de la formule est la masse de la formule empirique d'une substance particulière. | La masse moléculaire est la masse d'une molécule dans une substance particulière. |
| Valeur | |
| La valeur de la masse de l'unité de formule est toujours plus petite ou similaire à la masse moléculaire de la même substance. | La valeur de la masse moléculaire est toujours plus grande ou similaire à la masse de l'unité de formule de la même substance. |
Résumé - Formule Masse unitaire vs masse moléculaire
La masse de l'unité de formule est la masse de la formule empirique d'une substance particulière. La masse moléculaire d'une substance est la masse réelle d'une molécule d'une substance particulière. La différence entre la masse de l'unité de formule et la masse moléculaire est que la valeur de la masse de l'unité de formule est toujours plus petite ou similaire à la masse moléculaire de la même substance alors que la valeur de la masse moléculaire est toujours plus grande ou similaire à la masse unitaire de formule de la même substance.
Référence:
1.Helmenstine, Anne Marie, D. «Masse de formule contre masse moléculaire."Thoughtco, mar. 25, 2017. Disponible ici
2."Masse moléculaire.»Wikipedia, Wikimedia Foundation, 25 février. 2018. Disponible ici
3."Formule empirique.»Wikipedia, Wikimedia Foundation, 18 février. 2018. Disponible ici
Image gracieuseté:
1.'Alpha-D-Glucose Haworth'By Masur (domaine public) via Commons Wikimedia


