Différence entre l'éthylène glycol et le polyéthylène glycol
Différence clé - éthylène glycol vs polyéthylène glycol
L'éthylène glycol et le polyéthylène glycol sont deux membres importants de la famille du glycol. La principale différence entre l'éthylène glycol et le polyéthylène glycol est leur structure chimique. L'éthylène glycol est une molécule linéaire simple, tandis que le polyéthylène glycol est un matériau polymère. De plus, ces deux composés sont commercialement très importants et utilisés dans un certain nombre d'applications.
Qu'est-ce que l'éthylène glycol?
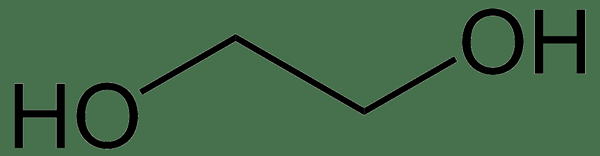
Le nom IUPAC de l'éthylène glycol est l'éthane-1,2-diol, et sa formule moléculaire est (ch2OH)2. Il s'agit d'un composé organique qui peut être utilisé comme matière première pour fabriquer des fibres de polyester et des formulations d'antigel. C'est un alcool visqueux de dihydroxy sans odeur, incolore et au goût sucré. L'éthylène glycol est modérément toxique s'il est ingéré. Il s'agit du glycol le plus couramment disponible et est produit commercialement en grande quantité. Il a de nombreuses applications industrielles; Il est utilisé comme liquide de refroidissement antigel dans les fluides hydrauliques et dans la fabrication de dynamites et de résines à faible congélation.
Qu'est-ce que le polyéthylène glycol?
Le polyéthylène glycol (PEG) est un composé polymère, et il est utilisé dans un large éventail de domaines tels que les applications chimiques, biologiques, médicales, industrielles et commerciales. Il est également connu sous le nom oxyde de polyéthylène (PEO) ou polyoxyéthylène (POE), en fonction de son poids moléculaire. Sa 'structure est généralement écrite comme H− (O - Ch2−CH2)n−Oh. Le PEG est un liquide clair ou un solide blanc soluble dans l'eau avec une odeur légère.
Quelle est la différence entre l'éthylène glycol et le polyéthylène glycol?
Formule moléculaire
Éthylène glycol: L'éthylène glycol est un diol avec la formule moléculaire (ch2-OH)2.
Polyéthylène glycol: La formule moléculaire de PEG est (c2H4O)n + 1H2O et sa formule structurelle sont exprimées comme ci-dessous.
Production:
Éthylène glycol: L'éthylène est le principal composé chimique utilisé pour produire de l'éthylène glycol. Au cours de ce processus, l'oxyde d'éthylène est produit comme intermédiaire, puis il réagit avec l'eau pour produire de l'éthylène glycol.
C2H4O + H2O → Ho-ch2Ch2-OH
Les acides et les bases peuvent être utilisés comme catalyseurs pour cette réaction. De plus, la réaction se produit à un pH neutre à des températures élevées. Un rendement élevé (90%) peut être obtenu lorsque la réaction se produit au pH acide ou neutre, en présence d'une quantité excessive d'eau.
Polyéthylène glycol: La réaction entre l'oxyde d'éthylène avec de l'eau, de l'éthylène glycol ou des oligomères éthylène glycol produit du polyéthylène glycol. Les catalyseurs acides et de base sont utilisés pour catalyser cette réaction. La réaction entre l'éthylène glycol et ses oligomères est préférable qu'avec l'eau. La longueur de la chaîne polymère dépend du rapport des réactifs. Le mécanisme de polymérisation peut être une polymérisation cationique ou anionique en fonction du type de catalyseur.
Hoch2Ch2Oh + n (ch2Ch2O) → ho (ch2Ch2O)n + 1H
Les usages:
Éthylène glycol: L'éthylène glycol est principalement utilisé dans les formulations d'antigel et en tant que matière première dans la fabrication de polyesters tels que le téréphtalate de polyéthylène (PET) dans l'industrie plastique. L'éthylène glycol peut faciliter le transfert de chaleur convectif dans les automobiles et les ordinateurs refroidis liquides. Il est également utilisé dans les systèmes de climatisation à eau réfrigérée.
Polyéthylène glycol: Le polyéthylène glycol possède une faible toxicité et donc il est utilisé comme revêtement lubrifiant pour les environnements aqueux et non aqueux. Il est également utilisé comme phase stationnaire polaire dans la chromatographie en phase gazeuse et comme fluide de transfert de chaleur dans les testeurs électroniques. Peg est la base pour de nombreuses crèmes de peau et lubrifiants personnels. Il est utilisé dans un certain nombre de dentifrices comme dispersant et comme agent anti-monnaie dans les applications industrielles alimentaires.
Références: «Ethylène glycol» - base de données de chimie ouverte «éthylène glycol» - Wikipedia «Polyethylène glycol» - Wikipedia «Polyethylène glycol» - Université de Teknologi Mara Image Courterité: «Structure chimique de l'éthylène glycol» (CC By-Sa 3.0) Via Commons Wikimedia «Polyéthylène glycol» de Klaus Hoffmeier - Propre travaux (domaine public) via Commons Wikimedia

