Différence entre l'élimination et la réaction de substitution
Différence clé - Élimination vs réaction de substitution
Les réactions d'élimination et de substitution sont deux types de réactions chimiques principalement trouvées dans la chimie organique. Le différence clé entre l'élimination et la réaction de substitution peut être mieux expliquée en utilisant leur mécanisme. Dans la réaction d'élimination, le réarrangement des liaisons précédentes se produit après la réaction, tandis que la réaction de substitution remplace un groupe de départ par un nucléophile. Ces deux réactions se concurrent et sont influencées par plusieurs autres facteurs. Ces conditions varient d'une réaction à une autre.
Qu'est-ce qu'une réaction d'élimination?
Des réactions d'élimination sont trouvées dans la chimie organique, et le mécanisme implique l'élimination de deux substituants d'une molécule organique en une ou deux étapes. Lorsque la réaction se produit dans un mécanisme à étape unique, il est connu sous le nom Réaction E2 (réaction bi-moléculaire), Et quand il a un mécanisme en deux étapes, il est connu sous le nom Réaction E1 (réaction unimoléculaire). En général, la plupart des réactions d'élimination impliquent la perte d'au moins un atome d'hydrogène pour former la double liaison. Cela augmente l'insaturation de la molécule.

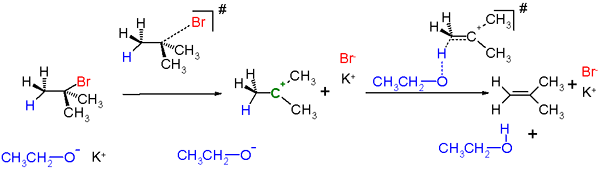
Réaction E1
Qu'est-ce qu'une réaction de substitution?
Les réactions de substitution sont un type de réactions chimiques qui impliquent le remplacement d'un groupe fonctionnel dans un composé chimique par un autre groupe fonctionnel. Les réactions de substitution sont également appelées «réactions de déplacement unique» ou «réactions de remplacement unique.`` Ces réactions sont très importantes en chimie organique, et elles sont principalement classées en deux groupes, sur la base des réactifs impliqués dans la réaction: réaction de substitution électrophile et réaction de substitution nucléophile. Ces deux types de réactions de substitution existent comme sN1 réaction et sN2 réaction.
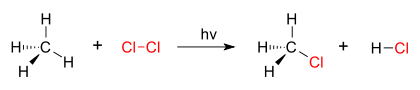
Réaction de substitution - chloration méthane
Quelle est la différence entre l'élimination et la réaction de substitution?
Mécanisme:
Réaction d'élimination: Les réactions d'élimination peuvent être divisées en deux catégories; Réactions E1 et réactions E2. Les réactions E1 ont deux étapes dans la réaction et les réactions E1 ont un mécanisme à étape unique.
Réaction de substitution: Les réactions de substitution sont divisées en deux catégories en fonction de leur mécanisme de réaction: SN1 réactions etN2 réactions.
Propriétés:
Réaction d'élimination:
Réactions E1: Ces réactions sont non stéréospécifiques, et elles suivent la règle Zaitsev (Saytseff). Un intermédiaire de carbocation se forme dans la réaction de sorte que ces réactions sont des réactions non concernées. Ce sont des réactions non imoléculaires car la vitesse de réaction ne dépend que de la concentration. Ces réactions n'ont pas lieu avec des halogénures d'alkyle primaires (groupes de départ). Les acides forts sont capables de promouvoir la perte de OH comme h2O ou ou comme hor si une carbocation tertiaire ou conjuguée peut être formée comme l'intermédiaire.
Réactions E2: Ces réactions sont stéréospécifiques; La géométrie anti-périplanaire est préférée, mais la géométrie synperiplanar est également possible. Ils sont concertés et considérés comme des réactions bimoléculaires car la vitesse de réaction dépend de la concentration de la base et du substrat. Ces réactions sont favorisées par de fortes bases.
Réaction de substitution:
SN1 réactions: Ces réactions seraient non stéréospécifiques car le nucléophile peut attaquer la molécule des deux côtés. Un carbocation stable se forme dans la réaction et ces réactions sont donc des réactions non confiées. La vitesse de la réaction ne dépend que de la concentration du substrat, et elles sont appelées réactions unimoléculaires.
SN2 réactions: Ces réactions sont stéréospécifiques et concertées. La vitesse de la réaction dépend de la concentration à la fois de nucléophile et du substrat. Ces réactions se produisent considérablement lorsque le nucléophile est plus réactif (plus anionique ou basique).
Définitions:
Stéréospécifique:
Dans une réaction chimique, la production d'une forme stéréomère particulière du produit, quelle que soit la configuration du réactif.
Réactions concertées:
La réaction concertée est une réaction chimique où toutes les liaisons se cassent et se forment en une seule étape.
Références: «Réaction d'élimination." Wikipédia. Consulté le 13 septembre 2016. Ici «Réaction de substitution." Wikipédia. Consulté le 13 septembre 2016. Ici «Réactions de substitution et d'élimination.”Khan Academy. Consulté le 13 septembre 2016. Ici «Menu des mécanismes d'élimination.»Chemguide. Consulté le 13 septembre 2016. ici «substitution nucléophile.”McGraw-Hill Education. Consulté le 13 septembre 2016. ici «SN2, SN1, E2 et E1: réactions de substitution et d'élimination.”PDF. ici Image gracieuseté: «E1 Elimination Reaction» de V8rik à la langue anglaise Wikipedia (CC BY-SA 3.0) via Commons Wikimedia «Réaction de substitution» par V8rik à l'anglais Wikipedia (CC BY-SA 3.0) via Commons Wikimedia

