Différence entre dipol-dipole et forces de dispersion de Londres
Différence clé - Dipole-dipole vs forces de dispersion de Londres
Les forces de dispersion dipol-dipole et Londres sont deux forces d'attraction trouvées entre les molécules ou les atomes; Ils affectent directement le point d'ébullition de l'atome / molécule. Le différence clé entre dipol-dipole et forces de dispersion de Londres est leur force et où ils peuvent être trouvés. Le La force des forces de dispersion de Londres est relativement plus faible que les interactions dipol-dipole; Cependant, ces deux attractions sont plus faibles que les liaisons ioniques ou covalentes. Les forces de dispersion de Londres peuvent être trouvées dans n'importe quelle molécule ou parfois dans les atomes, mais les interactions dipol-dipole ne se trouvent que dans les molécules polaires.
Qu'est-ce que la force dipol-dipole?
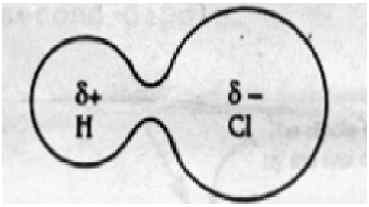
Les interactions dipol-dipole se produisent lorsque deux molécules polarisées opposées interagissent dans l'espace. Ces forces existent dans toutes les molécules polaires. Des molécules polaires se forment lorsque deux atomes ont une différence d'électronégativité lorsqu'ils forment une liaison covalente. Dans ce cas, les atomes ne peuvent pas partager uniformément les électrons entre deux atomes en raison de la différence d'électronégativité. Plus l'atome électronégatif attire le nuage d'électrons plus que l'atome moins électronégatif; de sorte que la molécule résultante possède une extrémité légèrement positive et une extrémité légèrement négative. Les dipôles positifs et négatifs dans d'autres molécules peuvent s'attirer les uns les autres, et cette attraction est appelée forces dipol-dipole.

Qu'est-ce que Londres Force de dispersion?
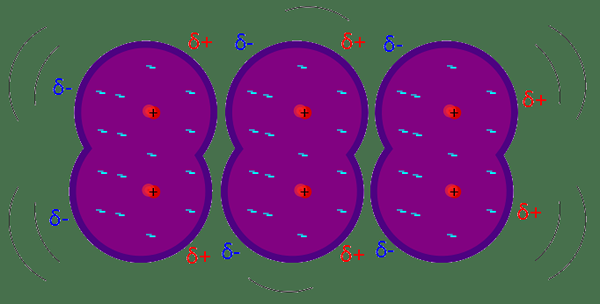
Les forces de dispersion de Londres sont considérées comme la force intermoléculaire la plus faible entre les molécules ou les atomes adjacents. Les forces de dispersion de Londres entraînent une fluctuation de la distribution d'électrons dans la molécule ou l'atome. Par exemple; Ces types de forces d'attraction surviennent dans les atomes voisins en raison d'un dipôle instantané sur n'importe quel atome. Il induit un dipôle sur les atomes voisins et s'attire ensuite par des forces d'attraction faibles. L'ampleur de la force de dispersion de Londres dépend de la facilité avec laquelle les électrons de l'atome ou de la molécule peuvent être polarisés en réponse à une force instantanée. Ce sont des forces temporaires qui peuvent être disponibles dans n'importe quelle molécule car ils ont des électrons.

Quelle est la différence entre les forces de dispersion dipol-dipole et Londres?
Définition:
Force dipôle-dipole: La force dipol-dipole est la force d'attraction entre le dipôle positif d'une molécule polaire et le dipôle négatif d'une autre molécule polarisée opposée.
Force de dispersion de Londres: La force de dispersion de Londres est la force d'attraction temporaire entre les molécules ou les atomes adjacents en cas de fluctuation dans la distribution d'électrons.
Nature:
Force dipôle-dipole: Les interactions dipol-dipole se trouvent dans les molécules polaires telles que HCl, BRCL et HBR. Cela survient lorsque deux molécules partagent les électrons de manière inégale pour former une liaison covalente. La densité électronique se déplace vers l'atome plus électronégatif, entraînant un dipôle légèrement négatif à une extrémité et un dipôle légèrement positif à l'autre extrémité.
Force de dispersion de Londres: Les forces de dispersion de Londres peuvent être trouvées dans n'importe quel atome ou molécule; l'exigence est un nuage d'électrons. Les forces de dispersion de Londres se trouvent également dans les molécules et les atomes non polaires.
Force:
Force dipôle-dipole: Les forces dipol-dipoles sont plus fortes que les forces de dispersion mais plus faibles que les liaisons ioniques et covalentes. La force moyenne des forces de dispersion varie entre 1 et 10 kcal / mol.
Force de dispersion de Londres: Ils sont faibles parce que les forces de dispersion de Londres sont des forces temporaires (0-1 kcal / mol).
Facteurs affectant:
Force dipôle-dipole: Les facteurs affectants de la résistance des forces dipol-dipole sont la différence d'électronégativité entre les atomes de la molécule, la taille moléculaire et la forme de la molécule. En d'autres termes, lorsque la longueur de liaison augmente, l'interaction dipolaire diminue.
Force de dispersion de Londres: L'ampleur des forces de dispersion de Londres dépend de plusieurs facteurs. Il augmente avec le nombre d'électrons dans l'atome. La polarisabilité est l'un des facteurs importants qui affectent la force des forces de dispersion de Londres; c'est la capacité de déformer le nuage d'électrons par un autre atome / molécule. Les molécules ayant une moindre électronégativité et des rayons plus grands ont une polarisabilité plus élevée. En revanche; Il est difficile de déformer le nuage d'électrons dans des atomes plus petits car les électrons sont très proches du noyau.
Exemple:
| Atome | Point d'ébullition / oC | |
| Hélium | (Il) | -269 |
| Néon | (Ne) | -246 |
| Argon | (Ar) | -186 |
| Krypton | (Kr) | -152 |
| Xénon | (Xe) | -107 |
| Redonner | (RN) | -62 |
RN- Plus l'atome est grand, facile à polariser (polarisabilité plus élevée) et possède les forces d'attraction les plus fortes. L'hélium est très petit et difficile à déformer et à entraîner des forces de dispersion de Londres plus faibles.
Image gracieuseté:
1. Dipole-dipole-interaction-in-hcl-2d par Benjah-bmm27 (propre travail) [domaine public], via Wikimedia Commons
2. Forze di London par Riccardo Rovinetti (Propre travail) [CC BY-SA 3.0], via Wikimedia Commons


