Différence entre le point critique et le point triple
Différence clé - point critique vs Tripler Indiquer
Le point critique et le point triple sont des termes utilisés pour expliquer les températures et les pressions auxquelles deux ou plusieurs phases de substances peuvent coexister entre elles. Le point critique est la condition à laquelle la phase liquide et vapeur de la même substance coexiste. Le triple point est la condition dans laquelle les trois phases de la matière peuvent coexister les unes avec les autres. Le différence clé entre un point critique et le triple point est que Critical Point décrit la coexistence de deux phases de la même substance tandis que Triple Point décrit la coexistence de trois phases de la même substance.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le point critique
3. Qu'est-ce que Triple Point
4. Similitudes entre Critical Point et Triple Point
5. Comparaison côte à côte - point critique vs point triple dans la forme tabulaire
6. Résumé
Qu'est-ce que le point critique?
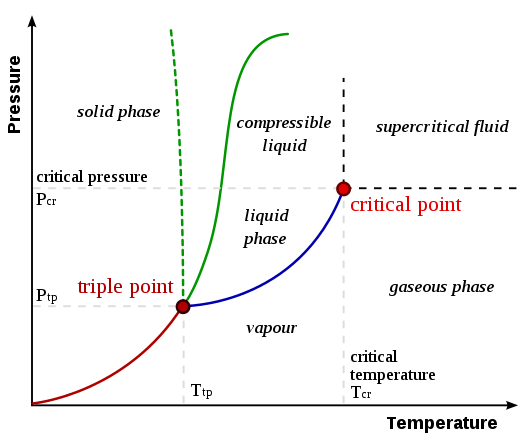
Le point critique d'une substance est le point final de la courbe d'équilibre de phase de cette substance. Une courbe d'équilibre de phase ou un diagramme de phase est le graphique de la pression par rapport à la température dans laquelle les changements de phase de la substance sont affichés. Cela montre les températures et la pression à laquelle la substance existe comme un solide, un liquide ou un gaz. Le point critique est la température et la pression à laquelle le liquide et la phase de vapeur coexistent.

Figure 01: Un diagramme de phase montrant à la fois le point critique et le point triple
La température et la pression au point critique sont nommées comme température critique (TC) et pression critique (PC). Comme le montre l'image ci-dessus, les lignes entre deux phases sont appelées limites. Un point critique indique le point auquel les limites de ligne disparaissent.
Connaître le point critique d'une substance est parfois très important. Par exemple, un gaz ne peut jamais être condensé à des températures et des pressions au-dessus de son point critique. En effet.
Il existe deux types du point critique;
-
Point critique de la vapeur liquide
C'est un point critique typique auquel la vapeur d'une substance coexiste avec sa forme liquide. Le point critique de l'eau est à 647 K et 22.064 MPA.
-
Point critique liquide-liquide
Ce type de points critiques est défini pour les solutions. C'est la température et la pression à laquelle un mélange de solution est séparé en deux phases liquides distinctes.
Qu'est-ce que Triple Point?
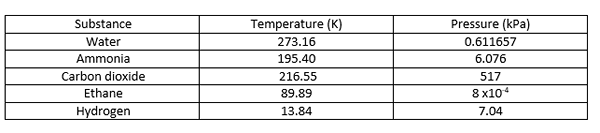
Le point triple est la température et la pression auxquelles les phases solides, liquides et vapeur d'une substance particulière coexistent en équilibre. Il décrit un état thermodynamique spécifique de mate. Parfois, le point triple peut impliquer plus d'une phase solide lorsqu'il existe des polymorphes de la substance. Dans un diagramme de phases, le triple point est le point auquel les trois lignes de limite se rencontrent. Quelques exemples de points triples sont donnés ci-dessous.
Quelles sont les similitudes entre Critical Point et Triple Point?
- Le point critique et le point triple décrivent certaines températures et pressions spécifiques.
- Le point critique et le point triple décrivent les états d'équilibre où deux ou plusieurs états physiques d'une substance coexistent.
Quelle est la différence entre Critical Point et Triple Point?
Point critique contre Triple Point | |
| Le point critique d'une substance est le point final de la courbe d'équilibre de phase de cette substance. | Le point triple est la température et la pression auxquelles les phases solides, liquides et vapeur d'une substance particulière coexistent en équilibre. |
| Phases | |
| Le point critique décrit la coexistence de deux phases de la même substance. | Triple Point décrit la coexistence de trois phases de la même substance. |
| L'eau comme exemple | |
| Le point critique de l'eau est à 647 K et 22.064 MPA. | Le triple point d'eau est à 273.16 K et 0.611657 MPA. |
| Diagramme de phase | |
| Le point critique est le point final d'une courbe de diagramme de phase. | Triple Point est le moment où toutes les lignes de limite se rencontrent. |
Résumé - Point critique vs Tripler Indiquer
Le point critique d'une substance est le point final de la courbe d'équilibre de phase de cette substance qui donne la température et la pression à laquelle la phase liquide et vapeur d'une substance peut coexister entre elles. Le triple point donne la température et la pression auxquelles les trois phases de la matière peuvent coexister les unes avec les autres. La différence entre un point critique et le point triple est que le point critique décrit la coexistence de deux phases de la même substance tandis que Triple Point décrit la coexistence de trois phases de la même substance.
Référence:
1.Helmenstine, Anne Marie, D. «Définition et exemple de triple point (chimie)."Thoughtco, nov. 10, 2017. Disponible ici
2."Point triple.»Wikipedia, Wikimedia Foundation, 6 mars. 2018. Disponible ici
3."Point critique.”Chemistry LibreTexts, LibreTexts, 21 juillet 2016. Disponible ici
Image gracieuseté:
1.'Phase-Diag2' par Matthieumarechal, (CC BY-SA 3.0) via Commons Wikimedia