Différence entre les solides ioniques et moléculaires
Différence clé - ionique vs solides moléculaires
Les substances solides sont des composés qui existent à un état solide à une température et une pression données. Un état solide signifie que les atomes, les molécules ou les ions dans cette substance sont étroitement emballés, évitant le mouvement de ces espèces chimiques (contrairement aux liquides ou aux gaz). Il existe deux principaux types de substances solides; solides ioniques et solides moléculaires. Les composés ioniques contiennent des ions qui sont maintenus ensemble via des liaisons chimiques ioniques. Les liaisons ioniques sont des forces d'attraction électrostatique entre les ions chargés de manière opposée. Les solides moléculaires sont des substances solides qui contiennent des molécules discrètes maintenues ensemble via les forces de van der Waal. Le différence clé entre les solides ioniques et les solides moléculaires est que Les solides ioniques contiennent des liaisons chimiques ioniques tandis que le solide moléculaire contient des forces van der Waal.
CONTENU
1. Aperçu et différence clé
2. Quels sont les solides ioniques
3. Que sont les solides moléculaires
4. Comparaison côte à côte - Solides moléculaires ioniques vs sous forme tabulaire
5. Résumé
Quels sont les solides ioniques?
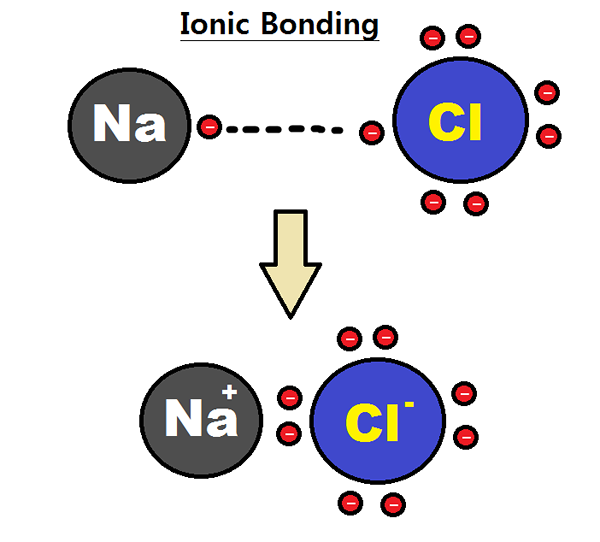
Les solides ioniques sont des composés solides composés d'ions de charge opposée maintenus ensemble par des attractions électrostatiques. Les ions sont des ions chargés positivement qui sont des cations et des ions chargés négativement qui sont appelés anions. La liaison chimique entre ces ions est connue sous le nom de liaison ionique. La charge globale du solide ionique est neutre. C'est parce que les cations sont entourées d'anions et vice versa.
Les solides ioniques peuvent contenir des ions simples tels que NA+ et cl- ou des ions complexes tels que l'ion ammonium (NH4+). Solides ioniques contenant h+ Les ions sont appelés composés acides car ces solides libèrent h+ Ions lorsqu'ils sont dissous dans l'eau (il réduit le pH du milieu aqueux). Solides ioniques contenant oh- Les ions sont appelés composés de base car ils libèrent oh- ions (il augmente le pH).
Les solides ioniques ont généralement des points de fusion élevés et des points d'ébullition. Ces solides sont durs et cassants. Lorsque les solides ioniques sont fondues, il devient hautement conducteur parce que la forme fondue des composés ioniques contient des ions qui peuvent conduire l'électricité. Les solides ioniques peuvent être formés via différents processus tels que l'évaporation, les précipitations, la congélation, etc.

Figure 01: Formation d'une liaison ionique
En règle générale, les solides ioniques ont des structures cristallines régulières. Là, les ions sont étroitement emballés de telle manière que l'énergie du réseau est minimisée. L'énergie du réseau est la quantité d'énergie nécessaire pour former un réseau d'ions complètement séparés.
Que sont les solides moléculaires?
Un solide moléculaire est un type de solide dans lequel les molécules sont maintenues ensemble par les forces de van der Waals plutôt que par des liaisons ioniques ou covalentes. Un solide moléculaire contient des molécules discrètes. Les forces van der Waal qui se lient à ces molécules les unes avec les autres sont plus faibles que les liaisons covalentes ou ioniques. Les molécules présentes dans ces solides moléculaires peuvent être monoatomiques, diatomiques ou même polyatomiques.
Étant donné que les forces intermoléculaires dans les solides moléculaires sont très faibles, ces composés solides ont des points de fusion plus faibles (souvent il est inférieur à 300 ° C). et aussi ces solides moléculaires sont relativement doux et ont des densités plus faibles. Cependant, il peut y avoir des liaisons hydrogène, des interactions dipol-dipole, des forces londoniennes, etc. aussi (au lieu des forces van der Waal).
Les forces van der Waal peuvent être observées entre les molécules non polaires. Les interactions dipol-dipole peuvent être observées dans les molécules polaires. Des liaisons hydrogène sont présentes entre des molécules contenant des groupes fonctionnels tels que O-H, N-H et F-H.
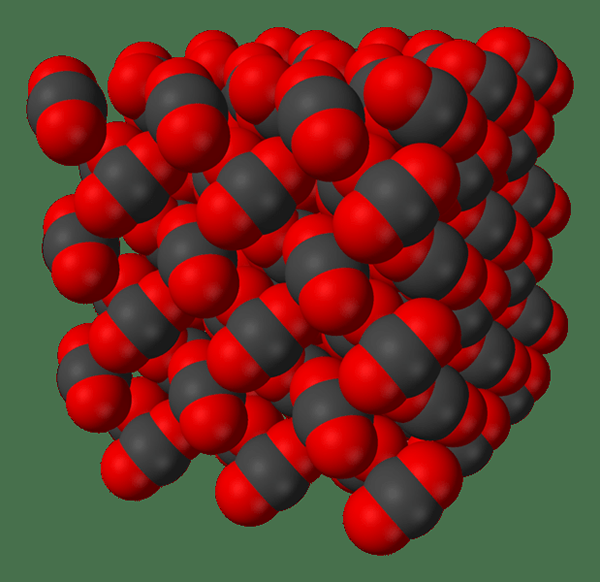
Figure 02: un diagramme montrant les molécules de dioxyde de carbone sous forme solide
Les forces Van der Waal faibles entre les molécules dans les solides moléculaires déterminent les propriétés du solide. Certaines de ces propriétés comprennent des points de fusion et d'ébullition faibles, une faible résistance mécanique, une faible conductivité électrique, une faible conductivité thermique, etc.
Quelle est la différence entre les solides ioniques et moléculaires?
Solides moléculaires ioniques vs | |
| Les solides ioniques sont des composés solides composés d'ions de charge opposée maintenus ensemble par des attractions électrostatiques. | Un solide moléculaire est un type de solide dans lequel les molécules sont maintenues ensemble par les forces de van der Waals plutôt que par des liaisons ioniques ou covalentes. |
| Liaisons chimiques | |
| Les solides ioniques ont des liaisons ioniques. | Les solides moléculaires ont principalement des forces de van der Waal, et il peut y avoir des liaisons hydrogène, des interactions dipol-dipole, des forces de Londres, etc. aussi. |
| Une force de liaison | |
| Les solides ioniques ont des liaisons fortes. | Les solides moléculaires ont des liaisons faibles. |
| Composants | |
| Les solides ioniques ont des cations et des anions. | Les solides moléculaires ont des molécules polaires ou non polaires. |
| Points de fusion et d'ébullition | |
| Les solides ioniques ont des points de fusion et d'ébullition élevés. | Les solides moléculaires ont de faibles points de fusion et d'ébullition. |
| Densité | |
| La densité des solides ioniques est très élevée. | La densité des solides moléculaires est très faible. |
| Nature | |
| Les solides ioniques sont durs et cassants. | Les solides moléculaires sont relativement doux. |
Résumé - ionique vs solides moléculaires
Les solides ioniques sont des composés solides en cations et anions. Il existe des forces d'attraction électrostatique entre ces ions chargés de facturation. Les solides moléculaires ont des molécules qui ont des forces intermoléculaires entre elles. Ce sont des interactions chimiques faibles. La différence entre les solides ioniques et les solides moléculaires est que les solides ioniques contiennent des liaisons chimiques ioniques tandis que le solide moléculaire contient des forces van der Waal.
Référence:
1.Helmenstine, Anne Marie, D. «Solide moléculaire - définition et exemples."Thoughtco, février. 19, 2017. Disponible ici
2.«Solides ioniques.”Chemistry LibreTexts, LibreTexts, 21 juillet 2016. Disponible ici
3.«Solide moléculaire.»Wikipedia, Wikimedia Foundation, 27 février. 2018. Disponible ici
Image gracieuseté:
1.'IonicBondingrh11'By Rhannosh - Propre travaux, (CC BY-SA 3.0) via Commons Wikimedia
2.«Carbon-dioxyde-cristal-3d-vdw'by ben Mills - propre travail, (domaine public) via les communes Wikimedia


