Différence entre réaction couplée et non couplée
Le différence clé entre la réaction couplée et non couplée est que Les réactions couplées montrent un transfert d'énergie d'un côté de la réaction à l'autre côté tandis que les réactions non couplées n'impliquent pas de transfert d'énergie.
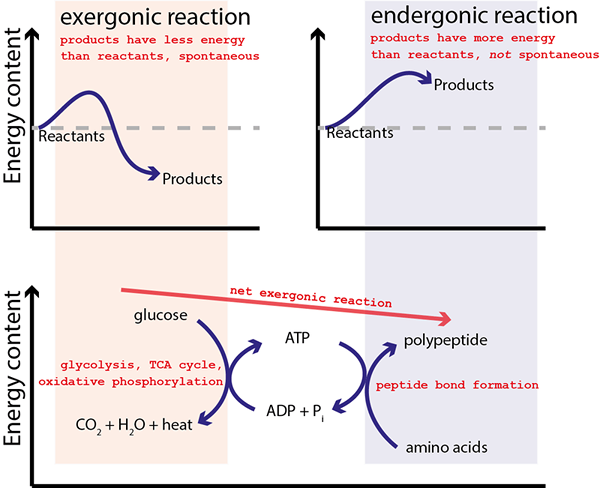
La plupart des réactions chimiques que nous connaissons sont endergoniques, ce qui signifie que les réactions ne sont pas spontanées. Par conséquent, l'énergie libre de Gibbs de ces réactions est supérieure à zéro. Ces réactions nécessitent l'énergie de l'environnement externe afin de se produire la réaction. Par conséquent, nous pouvons associer ces réactions avec une réaction exergonique séparée qui «entraîne» la réaction non spontanée. Ces deux réactions couplées partagent souvent des états intermédiaires.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce qu'une réaction couplée
3. Qu'est-ce qu'une réaction non couplée
4. Comparaison côte à côte - réaction couplée vs non couplée sous forme tabulaire
5. Résumé
Qu'est-ce qu'une réaction couplée?
Les réactions couplées sont des réactions chimiques ayant un état intermédiaire pour le processus de transfert d'énergie. En d'autres termes, ces réactions se forment à partir de la combinaison de deux réactions différentes où il y a un état intermédiaire commun dans lequel l'énergie est transférée d'un côté de la réaction à l'autre côté.
La plupart des réactions chimiques que nous connaissons sont Endegonic (non spontanée). Par conséquent, ces réactions nécessitent un approvisionnement énergétique pour la réaction. À cette fin, les réactions non spontanées peuvent être couplées à une autre réaction chimique qui peut fournir de l'énergie pour «conduire» la réaction non spontanée. La réaction chimique initiale était thermodynamiquement défavorable, et après le processus de couplage, il devient thermodynamiquement favorable. Les deux réactions sont réunies via un état intermédiaire commun aux deux réactions. Ensuite, l'énergie de Gibbs pour chaque demi-réaction peut être additionnée pour donner l'énergie libre de Gibbs combinée pour la réaction couplée.

Figure 01: Réactions couplées
Un exemple commun de réaction couplée est la formation d'ATP, qui est un processus d'endergonique, et il est couplé à la dissipation d'un gradient de proton.
Qu'est-ce qu'une réaction non couplée?
Les réactions non couplées sont des réactions chimiques qui n'ont pas d'état intermédiaire pour le transfert d'énergie. Un exemple pour une réaction non couplée est la réaction combinée du glucose et du fructose pour former du saccharose. Cette réaction est thermodynamiquement défavorable car elle nécessite une énergie élevée.
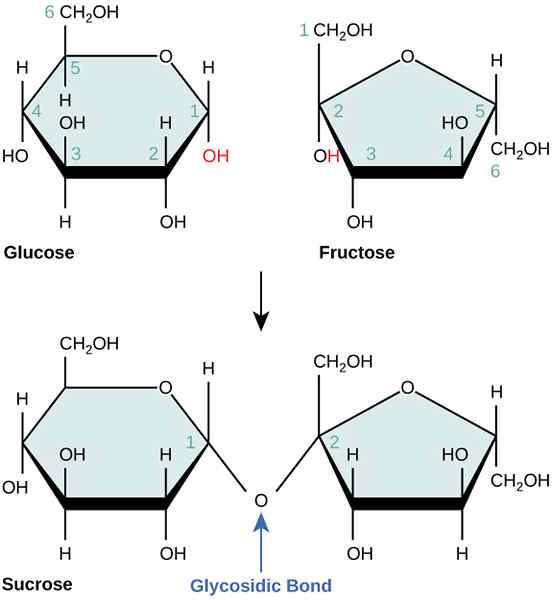
Figure 02: combinaison de glucose et de fructose pour former du saccharose
Cependant, si nous coupons cette réaction avec une réaction d'hydrolyse ATP, la réaction est possible et se déroule en deux étapes énergétiquement favorables, partageant un état intermédiaire commun. Alors ça devient une réaction couplée.
Quelle est la différence entre la réaction couplée et non couplée?
La plupart des réactions chimiques que nous connaissons sont non spontanées; Par conséquent, nous devons les coupler avec d'autres réactions afin de les faire progresser. Ainsi, ce nouveau type de réaction est appelé réaction couplée tandis que le type de réaction non spontané précédent est appelé une réaction non couplée. La principale différence entre la réaction couplée et non couplée est que les réactions couplées montrent que l'énergie se transfére d'un côté de la réaction à l'autre côté alors que dans les réactions non couplées, il n'y a pas de transfert d'énergie.
En dessous de l'infographie tabule plus de différences entre la réaction couplée et non couplée.
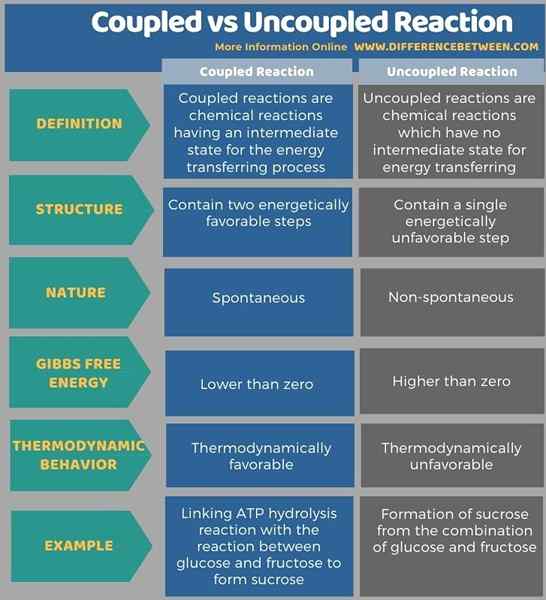
Résumé - réaction couplée vs non couplée
La plupart des réactions chimiques que nous connaissons sont non spontanées; Par conséquent, nous devons les coupler avec d'autres réactions afin de les faire progresser. Ce nouveau type de réaction est appelé réaction couplée tandis que le type de réaction non spontané précédent est appelé une réaction non couplée. La principale différence entre la réaction couplée et non couplée est que les réactions couplées montrent que l'énergie se transfére d'un côté de la réaction à l'autre côté alors que dans les réactions non couplées, il n'y a pas de transfert d'énergie.
Référence:
1. "7.7: réactions couplées.”Chemistry LibreTexts, LibreTexts, 11 août. 2020, disponible ici.
Image gracieuseté:
1. «Réactions couplées» de Muessig - Propre travaux (CC BY-SA 3.0) via Commons Wikimedia
2. «Figure 03 02 04» par CNX OpenStax - (CC par 4.0) via Commons Wikimedia


