Différence entre le droit combiné du gaz et le droit idéal du gaz
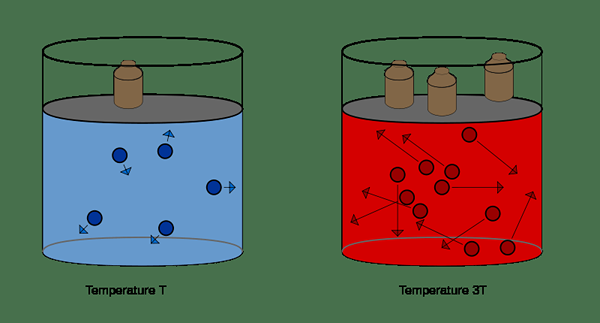
Différence clé - loi combinée au gaz vs Idéal Droit du gaz
Lorsque vous étudiez sur différents gaz, les relations entre le volume, la pression, la température du gaz et la quantité de gaz sont très importantes. Ces relations sont données par la loi sur le gaz idéal et la loi combinée au gaz. Lorsque vous expliquez ces lois, le terme «gaz idéal» est souvent utilisé. Un gaz idéal n'existe pas dans la réalité mais est un composé gazeux hypothétique. Il n'a pas de forces intermoléculaires entre les molécules de gaz. Cependant, certains gaz peuvent se comporter comme un gaz idéal lorsque des conditions appropriées (température et pression) sont fournies. Les lois sur le gaz sont créées pour les gaz idéaux. Lorsque vous utilisez ces lois sur le gaz pour les gaz réels, certaines corrections sont considérées. La loi combinée au gaz est une combinaison de trois lois sur le gaz; La loi de Boyle, la loi de Charles et la loi de Gay-Lussac. Le différence clé entre la loi combinée au gaz et le droit idéal du gaz est, le Le droit combiné du gaz est une collecte de trois lois sur le gaz alors que la loi idéale sur le gaz est une loi sur le gaz individuel.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le droit combiné du gaz
3. Qu'est-ce que la loi sur le gaz idéal
4. Relation entre le droit combiné du gaz et le droit idéal du gaz
5. Comparaison côte à côte - loi combinée au gaz vs droit de gaz idéal sous forme tabulaire
6. Résumé
Qu'est-ce que le droit combiné du gaz?
Le droit combiné du gaz est formé à partir de la combinaison de trois lois sur le gaz; La loi de Boyle, la loi de Charles et la loi de Gay-Lussac. Les lois de gaz combinées indiquent que le rapport du produit de la pression et du volume et la température absolue d'un gaz est égal à une constante.
Pv / t = k
Dans lequel p est la pression, v est le volume, t est la température et k est une constante. Lorsque la loi combinée au gaz est utilisée avec la loi d'Avogadro, elle se traduit par la loi idéale sur le gaz. La loi combinée au gaz n'a pas de propriétaire ni de découvreur. La relation ci-dessus peut également être donnée comme ci-dessous.
P1v1 / t1 = p2v2 / t2
Cela donne la relation entre le volume, la température et la pression d'un gaz idéal à deux états. Par conséquent, cette équation peut être utilisée pour expliquer et prédire ces paramètres à un état initial ou à l'état final.
La loi de Boyle
À température constante, le volume d'un gaz idéal est inversement proportionnel à la pression de ce gaz. Cela signifie que le produit de la pression initiale (P1) et du volume initial (V1) est égal au produit de la pression finale (P2) et du volume final (V2) du même gaz.
P1v1 = p2v2
La loi de Charles
À pression constante, le volume d'un gaz idéal est directement proportionnel à la température de ce gaz. Cette loi peut être donnée comme ci-dessous.
V1 / t1 = v2 / t2
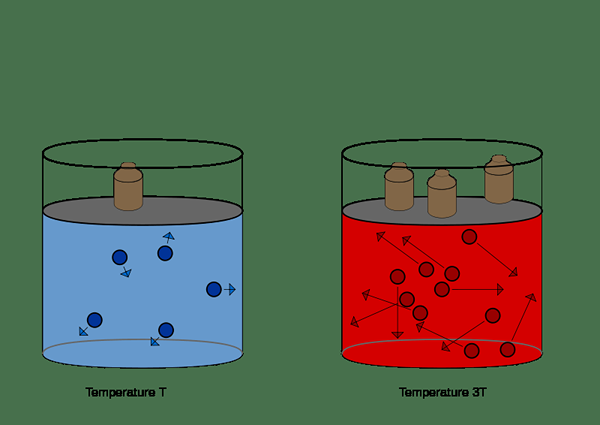
Figure 01: Illustration de la loi sur le volume de pression
Loi de Gay-Lussac
À un volume constant, la pression d'un gaz idéal est directement proportionnelle à la température du même gaz. Cela peut être donné comme ci-dessous,
P1 / t1 = p2 / t2
Qu'est-ce que la loi sur le gaz idéal?
La loi idéale sur le gaz est une loi fondamentale en chimie, et elle indique que le produit de la pression (P) et du volume (v) d'un gaz idéal est directement proportionnel au produit de la température (T) et un certain nombre de particules de gaz ( n).
PV = KNT
Ici, k est une constante de proportionnalité. Il est connu comme la constante de Boltzmann. La valeur de cette constante est 1.38 x 10-23 J / k. Cependant, le gaz idéal est simplement exprimé comme suit.
PV = NRT
Où n est le nombre de moles de gaz présents, et r est la constante de gaz universelle donnée par 8.314 JMOL-1K-1. Cette équation ne peut être utilisée que pour les gaz idéaux. S'il doit être utilisé pour les gaz réels, certaines corrections sont apportées parce que les gaz réels ont de nombreuses exceptions à partir de gaz idéaux.
Cette nouvelle équation est connue sous le nom Équation de van der Waals. Il est donné comme ci-dessous.
(P + a n / v2) (V / n - b) = rt
Dans cette équation, «A» est une constante qui dépend du type de gaz et B est également une constante qui donne le volume par mole de gaz (occupé par les molécules de gaz).
Quelle est la relation entre le droit combiné du gaz et le droit idéal du gaz?
- Lorsque la loi combinée au gaz est utilisée avec la loi d'Avogadro, elle se traduit par la loi idéale sur le gaz.
Quelle est la différence entre le droit combiné du gaz et le droit idéal du gaz?
Loi en gaz combinée vs droit du gaz idéal | |
| La loi combinée au gaz est formée à partir de la combinaison de trois lois sur le gaz; La loi de Boyle, la loi de Charles et la loi de Gay-Lussac. | La loi idéale sur le gaz est une loi fondamentale en chimie; Il indique que le produit de la pression (P) et du volume (v) d'un gaz idéal est directement proportionnel au produit de la température (T) et un certain nombre de particules de gaz (N). |
| Formation | |
| La loi combinée au gaz est formée par la combinaison de la loi de Boyle, de la loi de Charles et de la loi de Gay-Lussac. | La loi idéale sur le gaz est une loi individuelle. |
| Équation | |
| La loi combinée au gaz est donnée par PV / T = K | La loi sur le gaz idéal est donnée par PV = NRT |
Résumé - Droi de gaz combiné vs Idéal Droit du gaz
Les lois sur le gaz sont utilisées pour comprendre et prédire le comportement et les propriétés d'un gaz. La différence entre la loi combinée au gaz et la loi idéale sur le gaz est que la loi combinée au gaz est une collecte de trois lois sur le gaz alors que la loi idéale sur le gaz est une loi sur le gaz individuel. La loi combinée au gaz est formée à partir de la loi de Boyle, de la loi de Charles et de la loi de Gay-Lussac.
Référence:
1.Helmenstine, Anne Marie. «Comprendre le droit combiné du gaz en chimie."Thoughtco. Disponible ici
2.Helmenstine, Anne Marie. «Quelle est la loi sur le gaz idéal? Passez en revue vos concepts de chimie."Thoughtco. Disponible ici
3.«En quoi la loi idéale sur le gaz diffère-t-elle de la loi combinée au gaz? | Socratique."Org. Disponible ici
Image gracieuseté:
1.'Law Loi de la pression "par Egmason - Propre travaux, (CC BY-SA 3.0) via Commons Wikimedia
2.'37147128632'By Travis Wise (CC par 2.0) via Flickr


