Différence entre la théorie des collisions et la théorie de l'état de transition
Différence clé - collision Théorie contre Théorie de l'état de transition
La théorie des collisions et la théorie de l'état de transition sont deux théories qui sont utilisées pour expliquer les taux de réaction de différentes réactions chimiques au niveau moléculaire. La théorie des collisions décrit les collisions des molécules de gaz dans les réactions chimiques en phase gazeuse. La théorie de l'état de transition explique les taux de réaction en supposant la formation de composés intermédiaires qui sont des états de transition. Le différence clé entre la théorie des collisions et la théorie de l'état de transition est que La théorie des collisions concerne les collisions entre les molécules de gaz tandis que la théorie de l'état de transition se rapporte à la formation de composés intermédiaires dans les états de transition.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la théorie des collisions
3. Qu'est-ce que la théorie de l'état de transition
4. Comparaison côte à côte - Théorie des collisions vs théorie de l'état de transition sous forme tabulaire
5. Résumé
Qu'est-ce que la théorie des collisions?
La théorie des collisions explique que les réactions chimiques en phase gazeuse se produisent lorsque les molécules entrent en collision avec une énergie cinétique suffisante. Cette théorie est construite sur la base de la théorie cinétique des gaz (la théorie cinétique des gaz décrit que les gaz contiennent des particules n'ayant pas de volumes définis mais avec des masses définies et qu'il n'y a pas d'attractions intermoléculaires ou de répulsions entre ces particules de gaz).

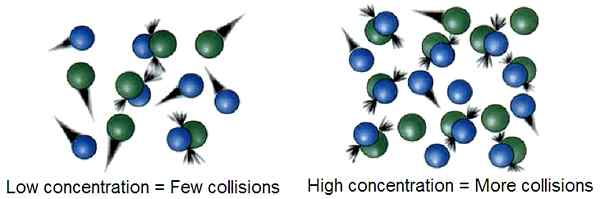
Figure 01: S'il y a beaucoup de particules de gaz dans un petit volume, alors la concentration est élevée, alors la probabilité de collision de deux particules de gaz est élevée. Il en résulte un nombre élevé de collisions réussies
Selon la théorie des collisions, seules quelques collisions entre les particules de gaz font que ces particules subissent des réactions chimiques considérables. Ces collisions sont connues comme des collisions réussies. L'énergie requise pour ces collisions réussies est connue sous le nom d'énergie d'activation. Ces collisions peuvent provoquer une rupture et une formation de liaisons chimiques.
Qu'est-ce que la théorie de l'état de transition?
La théorie de l'état de transition indique que, entre l'État où les molécules sont des réactifs et l'état où les molécules sont des produits, il existe un état appelé l'état de transition. La théorie de l'état de transition peut être utilisée pour déterminer les taux de réaction des réactions élémentaires. Selon cette théorie, les réactifs, les produits et les composés d'état de transition sont en équilibre chimique les uns avec les autres.
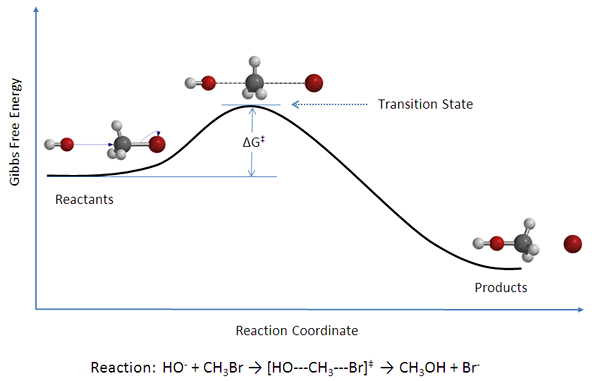
Figure 02: Un diagramme montrant des réactifs, des produits et des complexes d'états de transition
La théorie de l'état de transition peut être utilisée pour comprendre le mécanisme d'une réaction chimique élémentaire. Cette théorie est une alternative plus précise à la Équation d'Arrhenius. Selon la théorie de l'état de transition, il existe trois facteurs majeurs affectant le mécanisme d'une réaction;
- La concentration du composé de l'état de transition (connu sous le nom de complexe activé)
- Le taux de ventilation du complexe activé - Ceci détermine le taux de formation du produit souhaité
- La voie de la panne du complexe activé - Ceci détermine les produits formés dans la réaction chimique
Cependant, selon cette théorie, il existe deux approches d'une réaction chimique; Le complexe activé peut revenir à la forme du réactif, ou il peut se séparer afin de former des produits (s). La différence d'énergie entre l'énergie du réactif et l'énergie de l'état de transition est connue sous le nom d'énergie d'activation.
Quelle est la différence entre la théorie des collisions et la théorie de l'état de transition?
Théorie des collisions vs théorie de l'état de transition | |
| La théorie des collisions explique que les réactions chimiques en phase gazeuse se produisent lorsque les molécules entrent en collision avec une énergie cinétique suffisante. | La théorie de l'état de transition indique que, entre l'État où les molécules sont des réactifs et l'état où les molécules sont des produits, il existe un état appelé l'état de transition. |
| Principe | |
| La théorie des collisions stipule que les réactions chimiques (en phase gazeuse) se produisent en raison des collisions entre les réactifs. | La théorie de l'état de transition indique que les réactions chimiques se produisent en passant par un état de transition. |
| Exigences | |
| Selon la théorie des collisions, seules les collisions réussies provoquent des réactions chimiques. | Selon la théorie de l'état de transition, une réaction chimique progresse si les réactifs peuvent surmonter la barrière d'énergie d'activation. |
Résumé - collision Théorie contre Théorie de l'état de transition
La théorie des collisions et la théorie de l'état de transition sont utilisées pour expliquer les taux de réaction et les mécanismes de différentes réactions chimiques. La différence entre la théorie des collisions et la théorie de l'état de transition est que la théorie des collisions est liée aux collisions entre les molécules de gaz tandis que la théorie de l'état de transition se rapporte à la formation de composés intermédiaires dans les états de transition.
Référence:
1.«Théorie des collisions.”Chemistry LibreTexts, LibreTexts, 22 mai 2017. Disponible ici
2.«Théorie de l'état de transition.»Wikipedia, Wikimedia Foundation, 28 février. 2018. Disponible ici
3.«9.7: Théories des taux de réaction.”Chemistry LibreTexts, LibreTexts, 21 juillet 2016. Disponible ici
Image gracieuseté:
1.«Collisions moléculaires» par sadi_carnot (domaine public) via Commons Wikimedia
2.'RXN COORDINATINE SICHAGRAM 5'BY CHEM540GRP1F08 - PROPRE WORK, (CC BY-SA 3.0) via Commons Wikimedia


