Différence entre les réactifs catalytiques et stœchiométriques

Le différence clé entre les réactifs catalytiques et stoechiométriques est que Les réactifs catalytiques ne sont pas consommés pendant la réaction, tandis que les réactifs stoechiométriques sont consommés pendant la réaction.
Les réactifs catalytiques et les réactifs stœchiométriques sont deux types de réactifs dans une réaction chimique particulière. Les réactifs catalytiques sont supérieurs aux réactifs stœchiométriques. En effet.
CONTENU
1. Aperçu et différence clé
2. Quels sont les réactifs catalytiques
3. Quels sont les réactifs stoichiométriques
4. Comparaison côte à côte - réactifs catalytiques vs stoechiométriques sous forme tabulaire
5. Résumé
Quels sont les réactifs catalytiques?
Les réactifs catalytiques sont des réactifs en particulier des réactions chimiques qui ne sont pas consommées pendant la réaction. Le catalyseur est une substance qui peut augmenter la vitesse de réaction d'une réaction chimique particulière. Le processus d'augmentation de la vitesse de réaction est la «catalyse». La propriété la plus spécifique d'un catalyseur est que la réaction chimique ne consomme pas les catalyseurs pendant la progression de la réaction. Cependant, cette substance participe directement à la réaction. Par conséquent, cette substance recycle, et nous pouvons la séparer du mélange réactionnel afin de l'utiliser pour une autre réaction. De plus, nous n'avons besoin que d'une petite quantité de catalyseur pour la catalyse d'une réaction chimique.
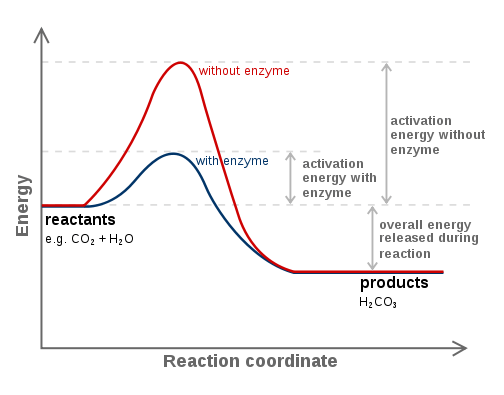
Figure 01: Les enzymes sont des bio-catalyseurs
Généralement, les réactions chimiques se produisent plus rapidement lorsqu'il y a un catalyseur. C'est parce qu'un catalyseur peut fournir une voie alternative pour que la réaction se produise. La voie alternative a toujours une faible énergie d'activation que la voie habituelle (qui se produit en l'absence de catalyseur). De plus, le catalyseur a tendance à former un intermédiaire avec le réactif, et il se régénère plus tard. Cependant, si une substance diminue le taux de réaction, nous l'appelons un inhibiteur.
Nous pouvons classer les catalyseurs comme des catalyseurs homogènes ou hétérogènes. S'il est homogène, cela signifie que le catalyseur et les réactifs sont dans la même phase de matière (i.e., phase liquide). D'un autre côté, si le catalyseur est dans une phase différente de celle des réactifs, alors c'est un catalyseur hétérogène. Ici, les réactifs gazeux adsorbés sur une surface de catalyseur solide.
Quels sont les réactifs stoichiométriques?
Les réactifs stoechiométriques sont des réactifs dans une réaction chimique qui sont consommés pendant la réaction. Par conséquent, un réactif stoechiométrique participe activement à la réaction chimique. En raison de cette consommation, le réactif stœchiométrique ne se régénère pas après la fin de la réaction.

Figure 02: différents réactifs
De plus, ce type de réactifs est différent des réactifs catalytiques car ils n'augmentent pas la vitesse de réaction (aucun effet sur l'énergie d'activation).
Quelle est la différence entre les réactifs catalytiques et stœchiométriques?
La principale différence entre les réactifs catalytiques et stœchiométriques est que les réactifs catalytiques ne sont pas consommés pendant la réaction, tandis que les réactifs stoechiométriques sont consommés pendant la réaction. Par conséquent, les réactifs catalytiques sont supérieurs aux réactifs stœchiométriques. De plus, les réactifs catalytiques peuvent diminuer la barrière d'énergie d'activation d'une réaction chimique, tandis que les réactifs stoichiométriques ne peuvent pas affecter l'énergie d'activation.
Le tableau suivant résume la différence entre les réactifs catalytiques et stœchiométriques.

Résumé - Réactifs catalytiques vs stoechiométriques
Les réactifs catalytiques et les réactifs stœchiométriques sont deux types de réactifs dans une réaction chimique particulière. La principale différence entre les réactifs catalytiques et stœchiométriques est que les réactifs catalytiques ne sont pas consommés pendant la réaction, tandis que les réactifs stoechiométriques sont consommés pendant la réaction. Par conséquent, les réactifs catalytiques sont supérieurs aux réactifs stœchiométriques.
Référence:
1. «Stoechiométrie." Wikipédia, Fondation Wikimedia, 18 février. 2020, disponible ici.
2. Helmenstine, Anne Marie. «Définition des réactifs et exemples."Thoughtco, mai. 8, 2019, disponible ici.
Image gracieuseté:
1. «Réaction de l'anhydrase carbonique dans les tissus» par fvasconcellos (parler · contribs) - Image: Activation2 mise à jour.SVG (CC BY-SA 3.0) via Commons Wikimedia
2. «Gram Stain Réactifs dans l'ordre Water Wash btwn chacun» par Niels Olson (CC BY-SA 2.0) via Flickr


