Différence entre l'acide carboxylique et l'alcool

Acide carboxylique vs alcool
Les acides carboxyliques et les alcools sont des molécules organiques avec des groupes fonctionnels polaires. Les deux ont la capacité de créer des liaisons hydrogène, ce qui affecte leurs propriétés physiques comme les points d'ébullition.
Acide carboxylique
Les acides carboxyliques sont les composés organiques ayant le groupe fonctionnel -cooh. Ce groupe est connu comme le groupe carboxyle. L'acide carboxylique a une formule générale comme suit.
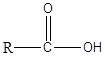
Dans le type le plus simple d'acide carboxylique, le groupe R est égal à H. Cet acide carboxylique est connu sous le nom d'acide formique. De plus, le groupe R peut être une chaîne de carbone droite, une chaîne ramifiée, un groupe aromatique, etc. L'acide acétique, l'acide hexanoïque et l'acide benzoïque sont quelques-uns des exemples d'acides carboxyliques. Dans la nomenclature IUPAC, les acides carboxyliques sont nommés en abandonnant la finale -e du nom de l'alcane correspondant à la chaîne la plus longue de l'acide et en ajoutant -acide OCI. Toujours, le carbone carboxyle est affecté le numéro 1. Les acides carboxyliques sont des molécules polaires. En raison du groupe -OH, ils peuvent former de fortes liaisons hydrogène entre elles et avec de l'eau. En conséquence, les acides carboxyliques ont des points d'ébullition élevés. De plus, les acides carboxyliques avec des poids moléculaires inférieurs se dissolvent facilement dans l'eau. Cependant, à mesure que la longueur de la chaîne de carbone augmente, la solubilité diminue. Les acides carboxyliques ont une acidité allant de PKA 4-5. Puisqu'ils sont acides, ils réagissent facilement avec Naoh et Nahco3 Solutions pour former des sels de sodium solubles. Les acides carboxyliques comme l'acide acétique sont des acides faibles, et ils existent en équilibre avec sa base conjuguée dans des milieux aqueux. Cependant, si les acides carboxyliques ont des groupes de retrait d'électrons comme Cl, F, ils sont acides que l'acide non substitué.
Alcool
La caractéristique de la famille d'alcool est la présence d'un groupe fonctionnel -OH (groupe hydroxyle). Normalement, ce groupe -OH est attaché à un sp3 carbone hybridé. Le membre le plus simple de la famille est l'alcool méthylique, également connu sous le nom de méthanol. Les alcools peuvent être classés en trois groupes comme primaires, secondaires et tertiaires. Cette classification est basée sur le degré de substitution du carbone auquel le groupe hydroxyle est directement attaché. Si le carbone n'a qu'un autre carbone qui y est attaché, le carbone est un carbone primaire et l'alcool est un alcool primaire. Si le carbone avec le groupe hydroxyle est attaché à deux autres carbones, alors c'est un alcool secondaire et ainsi de suite. Les alcools sont nommés avec un suffixe -ol Selon la nomenclature IUPAC. Premièrement, la chaîne de carbone continue la plus longue à laquelle le groupe hydroxyle est directement attaché doit être sélectionné. Alors le nom de l'alcane correspondant est modifié en abandonnant la finale e et ajoutant le suffixe ol.
Les alcools ont un point d'ébullition plus élevé que les hydrocarbures ou éthers correspondants. La raison en est la présence d'une interaction intermoléculaire entre les molécules d'alcool par liaison hydrogène. Si le groupe R est petit, les alcools sont miscibles avec de l'eau, mais à mesure que le groupe R devient plus grand, il a tendance à être hydrophobe. Les alcools sont polaires. Les liaisons C-O et les liaisons O-H contribuent à la polarité de la molécule. La polarisation de la liaison O-H rend l'hydrogène partiellement positif et explique l'acidité des alcools. Les alcools sont des acides faibles et l'acidité est proche de celle de l'eau. -Oh est un mauvais groupe de départ, parce que oh- est une base forte.
| Quelle est la différence entre Acide carboxylique et alcool? • Le groupe fonctionnel de l'acide carboxylique est -cooh, et en alcool il est -Oh. • Lorsque les deux groupes sont dans une molécule, une priorité est donnée à l'acide carboxylique dans la nomenclature. • Les acides carboxyliques ont une acidité plus élevée par rapport aux alcools correspondants. • Le groupe carboxylique et le groupe -OH donne des pics caractéristiques dans les spectres IR et RMN. |


